当前位置:
X-MOL 学术
›
Nano Today
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
基于粘膜粘附益生菌的口服微载体,可延长肠道滞留时间,用于治疗炎症性肠病
Nano Today ( IF 13.2 ) Pub Date : 2023-05-24 , DOI: 10.1016/j.nantod.2023.101876 Kairuo Wang , Qian Chen , Li Ding , Yefei Zhu , Xinyue Wang , Mengting Zhou , Meiqi Chang , Manman Pei , Yuanyuan Zhang , Yang Zhang , Yu Chen , Huanlong Qin

"点击查看英文标题和摘要"
更新日期:2023-05-24
Nano Today ( IF 13.2 ) Pub Date : 2023-05-24 , DOI: 10.1016/j.nantod.2023.101876 Kairuo Wang , Qian Chen , Li Ding , Yefei Zhu , Xinyue Wang , Mengting Zhou , Meiqi Chang , Manman Pei , Yuanyuan Zhang , Yang Zhang , Yu Chen , Huanlong Qin
|
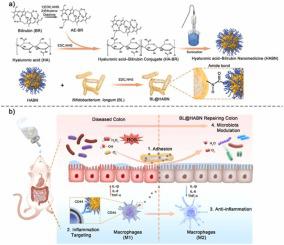
在肠道中的长时间滞留对口服药物有重要影响;然而,它仍然极具挑战性,尤其是在炎症性肠病 (IBD) 治疗方面。益生菌与宿主肠道的粘附可以延缓其通过肠道的转运,从而增强其有效性。受此特性的启发,我们开发了一种粘膜粘附性益生菌介导的治疗策略,使用活性氧 (ROS) 清除剂通过调节肠道炎症和微生物群实现生物粘附。长双歧杆菌(BL) 是一种黏附性口服益生菌,载入并与透明质酸-胆红素纳米药物 (HABN) 整合以生产 BL@HABN。体外和体内_, BL@HABN 粘附在上皮细胞上并表现出更长的停留时间,以介导预加载的 HABN 纳米药物更持久地释放,以消除过量的 ROS 并保护结肠上皮细胞免受 ROS 介导的细胞毒性。此外,BL@HABN 减少促炎细胞因子的产生,诱导 2 型巨噬细胞 (M2) 分化,促进上皮屏障修复。重要的是,它还恢复了肠道微生物群的丰富性和多样性,显着增加了益生菌的丰度,并抑制了有害细菌群落。这项研究扩大了细菌作为粘附载体的临床开发,并使口服纳米药物具有更长的停留时间和微生物群稳态。

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号