当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Ketoreductase Domain-Catalyzed Polyketide Chain Release in Fungal Alkyl Salicylaldehyde Biosynthesis
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2023-05-12 , DOI: 10.1021/jacs.3c02011 Run Yang 1 , Jian Feng 1 , Hao Xiang 1 , Bin Cheng 2 , Li-Dong Shao 3 , Yan-Ping Li 3 , Hang Wang 4 , Qiu-Fen Hu 1 , Wei-Lie Xiao 2 , Yudai Matsuda 5, 6 , Wei-Guang Wang 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2023-05-12 , DOI: 10.1021/jacs.3c02011 Run Yang 1 , Jian Feng 1 , Hao Xiang 1 , Bin Cheng 2 , Li-Dong Shao 3 , Yan-Ping Li 3 , Hang Wang 4 , Qiu-Fen Hu 1 , Wei-Lie Xiao 2 , Yudai Matsuda 5, 6 , Wei-Guang Wang 1
Affiliation
|
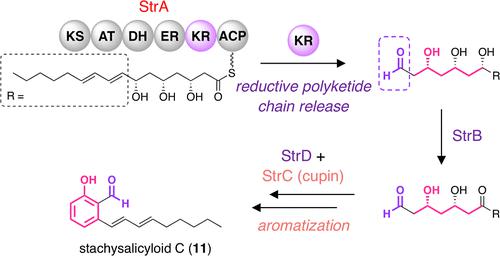
Alkyl salicylaldehyde derivatives are polyketide natural products, which are widely distributed in fungi and exhibit great structural diversity. Their biosynthetic mechanisms have recently been intensively studied; however, how the polyketide synthases (PKSs) involved in the fungal alkyl salicylaldehyde biosyntheses release their products remained elusive. In this study, we discovered an orphan biosynthetic gene cluster of salicylaldehyde derivatives in the fungus Stachybotrys sp. g12. Intriguingly, the highly reducing PKS StrA, encoded by the gene cluster, performs a reductive polyketide chain release, although it lacks a C-terminal reductase domain, which is typically required for such a reductive release. Our study revealed that the chain release is achieved by the ketoreductase (KR) domain of StrA, which also conducts cannonical β-keto reductions during polyketide chain elongation. Furthermore, we found that the cupin domain-containing protein StrC plays a critical role in the aromatization reaction. Collectively, we have provided an unprecedented example of a KR domain-catalyzed polyketide chain release and a clearer image of how the salicylaldehyde scaffold is generated in fungi.
中文翻译:

真菌烷基水杨醛生物合成中酮还原酶域催化的聚酮化合物链释放
烷基水杨醛衍生物是聚酮化合物的天然产物,广泛分布于真菌中,具有很大的结构多样性。最近对它们的生物合成机制进行了深入研究;然而,参与真菌烷基水杨醛生物合成的聚酮化合物合酶 (PKS) 如何释放其产物仍不清楚。在这项研究中,我们在真菌Stachybotrys中发现了水杨醛衍生物的孤儿生物合成基因簇sp。g12. 有趣的是,由基因簇编码的高度还原性 PKS StrA 执行还原性聚酮化合物链释放,尽管它缺少 C 端还原酶域,而 C 端还原酶域通常是此类还原性释放所必需的。我们的研究表明,链释放是通过 StrA 的酮还原酶 (KR) 结构域实现的,它还在聚酮化物链伸长过程中进行规范的 β-酮还原。此外,我们发现含有 cupin 结构域的蛋白质 StrC 在芳构化反应中起着关键作用。总的来说,我们提供了一个前所未有的 KR 结构域催化聚酮化合物链释放的例子,以及水杨醛支架如何在真菌中产生的更清晰的图像。
更新日期:2023-05-12
中文翻译:

真菌烷基水杨醛生物合成中酮还原酶域催化的聚酮化合物链释放
烷基水杨醛衍生物是聚酮化合物的天然产物,广泛分布于真菌中,具有很大的结构多样性。最近对它们的生物合成机制进行了深入研究;然而,参与真菌烷基水杨醛生物合成的聚酮化合物合酶 (PKS) 如何释放其产物仍不清楚。在这项研究中,我们在真菌Stachybotrys中发现了水杨醛衍生物的孤儿生物合成基因簇sp。g12. 有趣的是,由基因簇编码的高度还原性 PKS StrA 执行还原性聚酮化合物链释放,尽管它缺少 C 端还原酶域,而 C 端还原酶域通常是此类还原性释放所必需的。我们的研究表明,链释放是通过 StrA 的酮还原酶 (KR) 结构域实现的,它还在聚酮化物链伸长过程中进行规范的 β-酮还原。此外,我们发现含有 cupin 结构域的蛋白质 StrC 在芳构化反应中起着关键作用。总的来说,我们提供了一个前所未有的 KR 结构域催化聚酮化合物链释放的例子,以及水杨醛支架如何在真菌中产生的更清晰的图像。


















































 京公网安备 11010802027423号
京公网安备 11010802027423号