当前位置:
X-MOL 学术
›
Angew. Chem. Int. Ed.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Darobactin B Stabilises a Lateral-Closed Conformation of the BAM Complex in E. coli Cells
Angewandte Chemie International Edition ( IF 16.1 ) Pub Date : 2023-05-10 , DOI: 10.1002/anie.202218783 Samuel F Haysom 1 , Jonathan Machin 1 , James M Whitehouse 1 , Jim E Horne 1 , Katherine Fenn 1 , Yue Ma 2, 3, 4 , Hassane El Mkami 5 , Nils Böhringer 6, 7 , Till F Schäberle 6, 7, 8 , Neil A Ranson 1 , Sheena E Radford 1 , Christos Pliotas 2, 3, 4
Angewandte Chemie International Edition ( IF 16.1 ) Pub Date : 2023-05-10 , DOI: 10.1002/anie.202218783 Samuel F Haysom 1 , Jonathan Machin 1 , James M Whitehouse 1 , Jim E Horne 1 , Katherine Fenn 1 , Yue Ma 2, 3, 4 , Hassane El Mkami 5 , Nils Böhringer 6, 7 , Till F Schäberle 6, 7, 8 , Neil A Ranson 1 , Sheena E Radford 1 , Christos Pliotas 2, 3, 4
Affiliation
|
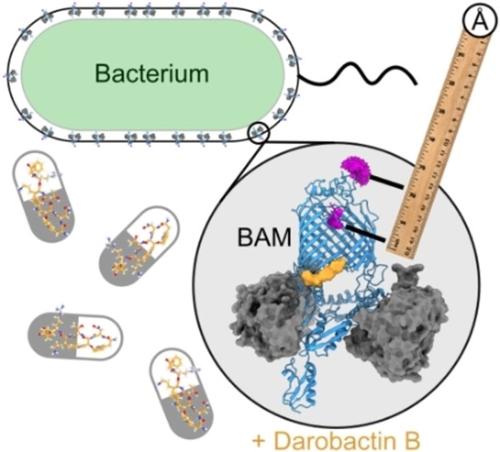
The darobactins are promising new antibiotics that inhibit the BAM complex, an essential membrane-protein foldase in Gram-negative bacteria. Here, we use EPR spectroscopy (PELDOR, or DEER) distance measurements to monitor the effect of darobactin B on BAM in E. coli cells, showing it stabilises BAM in a lateral gate closed conformational state. Our results provide the first direct evidence for conformational selection by a darobactin in the cellular context.
中文翻译:

Darobactin B 稳定大肠杆菌细胞中 BAM 复合物的侧闭合构象
darobactins 是有前途的新型抗生素,可抑制 BAM 复合物,BAM 复合物是革兰氏阴性菌中必不可少的膜蛋白折叠酶。在这里,我们使用 EPR 波谱(PELDOR 或 DEER)距离测量来监测 darobactin B 对大肠杆菌细胞中 BAM 的影响,表明它在侧门关闭构象状态下稳定 BAM。我们的结果为 darobactin 在细胞环境中的构象选择提供了第一个直接证据。
更新日期:2023-05-10
中文翻译:

Darobactin B 稳定大肠杆菌细胞中 BAM 复合物的侧闭合构象
darobactins 是有前途的新型抗生素,可抑制 BAM 复合物,BAM 复合物是革兰氏阴性菌中必不可少的膜蛋白折叠酶。在这里,我们使用 EPR 波谱(PELDOR 或 DEER)距离测量来监测 darobactin B 对大肠杆菌细胞中 BAM 的影响,表明它在侧门关闭构象状态下稳定 BAM。我们的结果为 darobactin 在细胞环境中的构象选择提供了第一个直接证据。































 京公网安备 11010802027423号
京公网安备 11010802027423号