当前位置:
X-MOL 学术
›
Food Hydrocoll.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
部分变性 β-乳球蛋白的分子模拟
Food Hydrocolloids ( IF 11.0 ) Pub Date : 2023-04-29 , DOI: 10.1016/j.foodhyd.2023.108811 Zhuo Zhang , Valeria Arrighi , Lydia Campbell , Julien Lonchamp , Stephen R. Euston

"点击查看英文标题和摘要"
更新日期:2023-05-03
Food Hydrocolloids ( IF 11.0 ) Pub Date : 2023-04-29 , DOI: 10.1016/j.foodhyd.2023.108811 Zhuo Zhang , Valeria Arrighi , Lydia Campbell , Julien Lonchamp , Stephen R. Euston
|
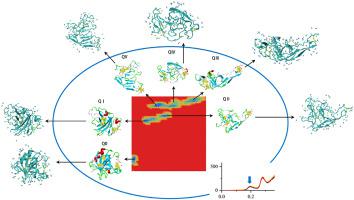
通过分子动力学计算机模拟,全面研究了加热后 β-乳球蛋白 (β-lac) 的展开。水溶液中的 β-lac 分子首先在 500 K 下加热展开,然后在 300 K 下退火以收集稳定的构象。基于自由能景观 (FEL),观察到五种亚稳态构象。发现 β-lac 分子在加热时表现出开放和延伸的构象,然后在冷却时进行有限的重折叠。半胱氨酸残基 –SH 121和 S–S 66-160在最开放的构象中,位于 β-lac 分子的相对末端。这将有利于已知在 β-lac 中发生的分子间 –SH/S–S 交换反应,作为分子间聚集过程的一部分。此外,β-lac 的展开增加了水分子与蛋白质之间以及水分子之间形成氢键的能力。蛋白质水合壳中水分子的相互作用和性质也表明水合壳通过蛋白质去折叠而稳定。然而,发现 β-lac 的展开增加了水合水分子的扩散,包括第一个水合壳中与蛋白质相互作用更强烈的水分子。这可能部分解释了为什么未折叠的蛋白质更容易聚集,即使有更多的水合水分子保护它们。这些结果提供了基于蛋白质分子及其水合壳的 β-lac 结构-功能关系的更详细信息。这让我们深入了解如何控制蛋白质的加工以获得所需的功能特性,例如增稠和凝胶化,这些特性通过蛋白质与水的相互作用进行修饰。

"点击查看英文标题和摘要"





















































 京公网安备 11010802027423号
京公网安备 11010802027423号