当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
How the Conformational Movement of the Substrate Drives the Regioselective C–N Bond Formation in P450 TleB: Insights from Molecular Dynamics Simulations and Quantum Mechanical/Molecular Mechanical Calculations
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2023-03-21 , DOI: 10.1021/jacs.2c12962 Zhanfeng Wang 1 , Wenwen Diao 1 , Peng Wu 2 , Junfeng Li 3 , Yuzhuang Fu 2 , Zhiyong Guo 4 , Zexing Cao 2 , Sason Shaik 5 , Binju Wang 2
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2023-03-21 , DOI: 10.1021/jacs.2c12962 Zhanfeng Wang 1 , Wenwen Diao 1 , Peng Wu 2 , Junfeng Li 3 , Yuzhuang Fu 2 , Zhiyong Guo 4 , Zexing Cao 2 , Sason Shaik 5 , Binju Wang 2
Affiliation
|
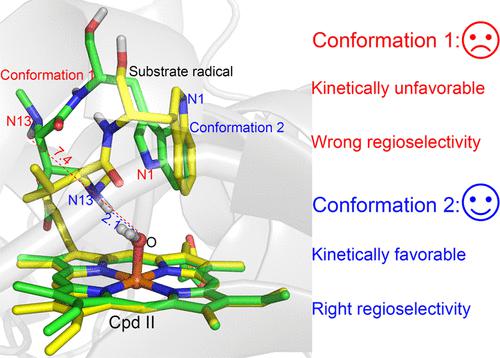
P450 TleB catalyzes the oxidative cyclization of the dipeptide N-methylvalyl-tryptophanol into indolactam V through selective intramolecular C–H bond amination at the indole C4 position. Understanding its catalytic mechanism is instrumental for the engineering or design of P450-catalyzed C–H amination reactions. Using multiscale computational methods, we show that the reaction proceeds through a diradical pathway, involving a hydrogen atom transfer (HAT) from N1–H to Cpd I, a conformational transformation of the substrate radical species, and a second HAT from N13–H to Cpd II. Intriguingly, the conformational transformation is found to be the key to enabling efficient and selective C–N coupling between N13 and C4 in the subsequent diradical coupling reaction. The underlined conformational transformation is triggered by the first HAT, which proceeds with an energy-demanding indole ring flip and is followed by the facile approach of the N13–H group to Cpd II. Detailed analysis shows that the internal electric field (IEF) from the protein environment plays key roles in the transformation process, which not only provides the driving force but also stabilizes the flipped conformation of the indole radical. Our simulations provide a clear picture of how the P450 enzyme can smartly modulate the selective C–N coupling reaction. The present findings are in line with all available experimental data, highlighting the crucial role of substrate dynamics in controlling this highly valuable reaction.
中文翻译:

底物的构象运动如何驱动 P450 TleB 中的区域选择性 C-N 键形成:来自分子动力学模拟和量子力学/分子力学计算的见解
P450 TleB 催化二肽N的氧化环化-methylvalyl-tryptophanol 通过选择性分子内 C-H 键胺化在吲哚 C4 位转化为吲哚内酰胺 V。了解其催化机制有助于工程化或设计 P450 催化的 C-H 胺化反应。使用多尺度计算方法,我们表明反应通过双自由基途径进行,涉及从 N1-H 到化合物 I 的氢原子转移 (HAT)、底物自由基物种的构象转变,以及从 N13-H 到第二个 HAT第二阶段计划书。有趣的是,构象转变被发现是在随后的双自由基偶联反应中实现 N13 和 C4 之间高效和选择性 C-N 偶联的关键。带下划线的构象转换是由第一个 HAT 触发的,随后进行需要能量的吲哚环翻转,然后是 N13-H 基团轻松接近 Cpd II。详细分析表明,来自蛋白质环境的内电场(IEF)在转化过程中起着关键作用,它不仅提供了驱动力,还稳定了吲哚自由基的翻转构象。我们的模拟清晰地展示了 P450 酶如何巧妙地调节选择性 C-N 偶联反应。目前的发现与所有可用的实验数据一致,突出了底物动力学在控制这种非常有价值的反应中的关键作用。这不仅提供了驱动力,而且稳定了吲哚自由基的翻转构象。我们的模拟清晰地展示了 P450 酶如何巧妙地调节选择性 C-N 偶联反应。目前的发现与所有可用的实验数据一致,突出了底物动力学在控制这种非常有价值的反应中的关键作用。这不仅提供了驱动力,而且稳定了吲哚自由基的翻转构象。我们的模拟清晰地展示了 P450 酶如何巧妙地调节选择性 C-N 偶联反应。目前的发现与所有可用的实验数据一致,突出了底物动力学在控制这种非常有价值的反应中的关键作用。
更新日期:2023-03-21
中文翻译:

底物的构象运动如何驱动 P450 TleB 中的区域选择性 C-N 键形成:来自分子动力学模拟和量子力学/分子力学计算的见解
P450 TleB 催化二肽N的氧化环化-methylvalyl-tryptophanol 通过选择性分子内 C-H 键胺化在吲哚 C4 位转化为吲哚内酰胺 V。了解其催化机制有助于工程化或设计 P450 催化的 C-H 胺化反应。使用多尺度计算方法,我们表明反应通过双自由基途径进行,涉及从 N1-H 到化合物 I 的氢原子转移 (HAT)、底物自由基物种的构象转变,以及从 N13-H 到第二个 HAT第二阶段计划书。有趣的是,构象转变被发现是在随后的双自由基偶联反应中实现 N13 和 C4 之间高效和选择性 C-N 偶联的关键。带下划线的构象转换是由第一个 HAT 触发的,随后进行需要能量的吲哚环翻转,然后是 N13-H 基团轻松接近 Cpd II。详细分析表明,来自蛋白质环境的内电场(IEF)在转化过程中起着关键作用,它不仅提供了驱动力,还稳定了吲哚自由基的翻转构象。我们的模拟清晰地展示了 P450 酶如何巧妙地调节选择性 C-N 偶联反应。目前的发现与所有可用的实验数据一致,突出了底物动力学在控制这种非常有价值的反应中的关键作用。这不仅提供了驱动力,而且稳定了吲哚自由基的翻转构象。我们的模拟清晰地展示了 P450 酶如何巧妙地调节选择性 C-N 偶联反应。目前的发现与所有可用的实验数据一致,突出了底物动力学在控制这种非常有价值的反应中的关键作用。这不仅提供了驱动力,而且稳定了吲哚自由基的翻转构象。我们的模拟清晰地展示了 P450 酶如何巧妙地调节选择性 C-N 偶联反应。目前的发现与所有可用的实验数据一致,突出了底物动力学在控制这种非常有价值的反应中的关键作用。

































 京公网安备 11010802027423号
京公网安备 11010802027423号