Investigational New Drugs ( IF 3.0 ) Pub Date : 2023-03-13 , DOI: 10.1007/s10637-023-01340-z Ilya Tsimafeyeu 1 , Galina Statsenko 2 , Liubov Vladimirova 3 , Natalia Besova 4 , Elena Artamonova 4 , Grigory Raskin 5 , Ivan Rykov 6 , Anastasia Mochalova 7 , Igor Utyashev 8 , Svetlana Gorbacheva 9 , Vasily Kazey 9 , Evgenia Gavrilova 10 , Nadezhda Dragun 10 , Vladimir Moiseyenko 11 , Sergei Tjulandin 4
|
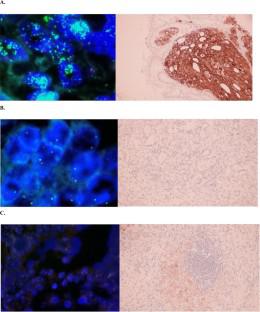
Alofanib 是一种小分子变构细胞外 FGFR2 抑制剂。我们报告了 alofanib 在经过大量预处理的晚期胃癌患者中进行的首次人体 1b 期研究的安全性和初步疗效。标准剂量递增设计 3+3 旨在确定最大耐受剂量 (MTD) 或推荐的 2 期剂量 (RP2D)。Alofanib 每天静脉内给药,给药 5 天,停药 2 天。有五个剂量水平(50-350 mg/m2)。所有患者均接受阿洛法尼治疗直至疾病进展或出现不可接受的毒性。登记了 21 名患者。患者主要为男性 (71%),67% 有 2 个或更多转移部位,包括肝转移 (43%),19% 有 ECOG PS 2,并且接受过大量预处理(86% 有 2 个或更多治疗线)。在剂量递增期间,未观察到剂量限制性毒性,并且未定义 MTD。15 名 (71.4%) 患者至少有一次与治疗相关的不良事件 (TRAE)。在 6 名患者 (28.6%) 中观察到 3 级或更高级别的 TRAE。最常见的 TRAE 包括给药后立即出现的反应、腹泻、血小板减少、关节痛和头痛。中位无进展生存期和总生存期分别为 3.63(95% CI 1.58-5.68)和 7.0(95% CI 3.82-10.18)个月。6 个月和 12 个月的总生存率分别为 57.1% 和 33.3%。疾病控制率为 68%,有一个持久的部分反应。尚未达到 MTD,剂量为 350 mg/m2,服药 5 天,停药 2 天已被宣布为 RP2D。Alofanib 在转移性胃癌的后线治疗中显示出可接受的耐受性和临床活性的初步迹象。4%)的患者至少有一次与治疗相关的不良事件(TRAE)。在 6 名患者 (28.6%) 中观察到 3 级或更高级别的 TRAE。最常见的 TRAE 包括给药后立即出现的反应、腹泻、血小板减少、关节痛和头痛。中位无进展生存期和总生存期分别为 3.63(95% CI 1.58-5.68)和 7.0(95% CI 3.82-10.18)个月。6 个月和 12 个月的总生存率分别为 57.1% 和 33.3%。疾病控制率为 68%,有一个持久的部分反应。尚未达到 MTD,剂量为 350 mg/m2,服药 5 天,停药 2 天已被宣布为 RP2D。Alofanib 在转移性胃癌的后线治疗中显示出可接受的耐受性和临床活性的初步迹象。4%)的患者至少有一次与治疗相关的不良事件(TRAE)。在 6 名患者 (28.6%) 中观察到 3 级或更高级别的 TRAE。最常见的 TRAE 包括给药后立即出现的反应、腹泻、血小板减少、关节痛和头痛。中位无进展生存期和总生存期分别为 3.63(95% CI 1.58-5.68)和 7.0(95% CI 3.82-10.18)个月。6 个月和 12 个月的总生存率分别为 57.1% 和 33.3%。疾病控制率为 68%,有一个持久的部分反应。尚未达到 MTD,剂量为 350 mg/m2,服药 5 天,停药 2 天已被宣布为 RP2D。Alofanib 在转移性胃癌的后线治疗中显示出可接受的耐受性和临床活性的初步迹象。在 6 名患者 (28.6%) 中观察到 3 级或更高级别的 TRAE。最常见的 TRAE 包括给药后立即出现的反应、腹泻、血小板减少、关节痛和头痛。中位无进展生存期和总生存期分别为 3.63(95% CI 1.58-5.68)和 7.0(95% CI 3.82-10.18)个月。6 个月和 12 个月的总生存率分别为 57.1% 和 33.3%。疾病控制率为 68%,有一个持久的部分反应。尚未达到 MTD,剂量为 350 mg/m2,服药 5 天,停药 2 天已被宣布为 RP2D。Alofanib 在转移性胃癌的后线治疗中显示出可接受的耐受性和临床活性的初步迹象。在 6 名患者 (28.6%) 中观察到 3 级或更高级别的 TRAE。最常见的 TRAE 包括给药后立即出现的反应、腹泻、血小板减少、关节痛和头痛。中位无进展生存期和总生存期分别为 3.63(95% CI 1.58-5.68)和 7.0(95% CI 3.82-10.18)个月。6 个月和 12 个月的总生存率分别为 57.1% 和 33.3%。疾病控制率为 68%,有一个持久的部分反应。尚未达到 MTD,剂量为 350 mg/m2,服药 5 天,停药 2 天已被宣布为 RP2D。Alofanib 在转移性胃癌的后线治疗中显示出可接受的耐受性和临床活性的初步迹象。中位无进展生存期和总生存期分别为 3.63(95% CI 1.58-5.68)和 7.0(95% CI 3.82-10.18)个月。6 个月和 12 个月的总生存率分别为 57.1% 和 33.3%。疾病控制率为 68%,有一个持久的部分反应。尚未达到 MTD,剂量为 350 mg/m2,服药 5 天,停药 2 天已被宣布为 RP2D。Alofanib 在转移性胃癌的后线治疗中显示出可接受的耐受性和临床活性的初步迹象。中位无进展生存期和总生存期分别为 3.63(95% CI 1.58-5.68)和 7.0(95% CI 3.82-10.18)个月。6 个月和 12 个月的总生存率分别为 57.1% 和 33.3%。疾病控制率为 68%,有一个持久的部分反应。尚未达到 MTD,剂量为 350 mg/m2,服药 5 天,停药 2 天已被宣布为 RP2D。Alofanib 在转移性胃癌的后线治疗中显示出可接受的耐受性和临床活性的初步迹象。2 天假已宣布为 RP2D。Alofanib 在转移性胃癌的后线治疗中显示出可接受的耐受性和临床活性的初步迹象。2 天假已宣布为 RP2D。Alofanib 在转移性胃癌的后线治疗中显示出可接受的耐受性和临床活性的初步迹象。(ClinicalTrials.gov 标识符:NCT04071184)。

"点击查看英文标题和摘要"






























 京公网安备 11010802027423号
京公网安备 11010802027423号