当前位置:
X-MOL 学术
›
Food Hydrocoll.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
β-乳球蛋白的蛋白质结构是否会影响其与 A 型明胶的复合凝聚以及复合物包埋叶黄素的能力?
Food Hydrocolloids ( IF 11.0 ) Pub Date : 2023-03-03 , DOI: 10.1016/j.foodhyd.2023.108651 Martin Daniel Aya Rodriguez , Danilo C. Vidotto , Ana Augusta O. Xavier , Raphaela A. Mantovani , Guilherme M. Tavares

"点击查看英文标题和摘要"
更新日期:2023-03-03
Food Hydrocolloids ( IF 11.0 ) Pub Date : 2023-03-03 , DOI: 10.1016/j.foodhyd.2023.108651 Martin Daniel Aya Rodriguez , Danilo C. Vidotto , Ana Augusta O. Xavier , Raphaela A. Mantovani , Guilherme M. Tavares
|
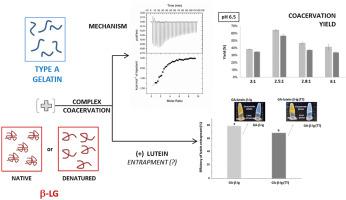
异蛋白复合物凝聚 (HPCC) 由带相反电荷的蛋白质之间的相互作用触发,导致两个液相处于平衡状态:富含蛋白质的凝聚相和蛋白质浓度低的平衡溶液。几个内在和外在因素影响 HPCC,包括所涉及蛋白质的性质和构象状态。在这项工作中,研究了 A 型明胶 (GA) 与天然和热处理(70 °C/5 分钟)β-乳球蛋白(β-lg 和 β-lg (TT))之间复杂凝聚的机制。此外,评估了获得的复合物凝聚层包埋叶黄素的能力。与未处理的热处理相比,热处理导致表面游离巯基浓度增加约 20%,β-Ig (TT) 的表面疏水性增加约 66%。然而,在蛋白质的聚集状态以及它们结合叶黄素的能力(Ksv 在 10 的数量级4 M -1)。GA-β-Ig 和 GA-β-Ig (TT) 之间复合凝聚的最佳条件是 pH 6.5,最小离子强度和质量比为 2.5:1。即使应用的热处理没有促进 GA-β-lg (TT) 之间分子相互作用的热力学参数与 GA-β-lg 之间分子相互作用的热力学参数的重要变化,它也会对凝聚产率产生负面影响(来自64% 到 57% 在最佳条件下)。两种获得的复合凝聚层均表现出高叶黄素包封效率,证明了它们保护和递送这种生物活性化合物的潜力。

"点击查看英文标题和摘要"





















































 京公网安备 11010802027423号
京公网安备 11010802027423号