当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
与固氮酶催化相关的 Fe 蛋白质循环需要为每个单电子转移事件水解两个 ATP
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2023-03-01 , DOI: 10.1021/jacs.2c09576 Zhi-Yong Yang 1 , Artavazd Badalyan 1 , Brian M Hoffman 2 , Dennis R Dean 3 , Lance C Seefeldt 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2023-03-01 , DOI: 10.1021/jacs.2c09576 Zhi-Yong Yang 1 , Artavazd Badalyan 1 , Brian M Hoffman 2 , Dennis R Dean 3 , Lance C Seefeldt 1
Affiliation
|
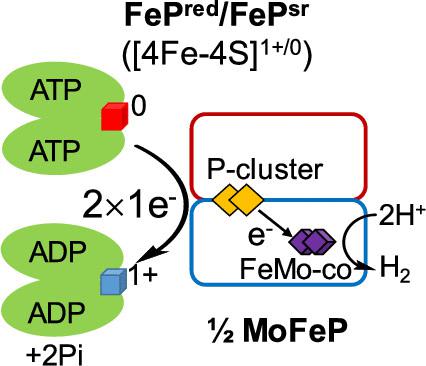
目前对通过固氮酶还原二氮 (N 2 ) 的理解的一个核心特征是建议将两个 ATP 的水解偶联,形成两个 ADP 和两个 Pi,以将一个电子从 Fe 蛋白质组分转移到MoFe蛋白质成分,底物减少。与 Fe 蛋白相关的氧化还原活性 [4Fe-4S] 簇是电子传递的代理,众所周知,它具有在单电子还原的 [4Fe-4S] 1+ 状态和单电子还原状态之间循环的能力氧化的 [4Fe-4S] 2+态。然而,最近已经表明,可以使用某些还原剂将 Fe 蛋白 [4Fe-4S] 簇进一步还原为超还原的全铁 [4Fe-4S] 0状态可以是抗磁的(S = 0)或顺磁的(S = 4)。有人提出,超还原状态可能从根本上改变固氮酶能量利用的现有模型,每个 Fe 蛋白质循环转移两个电子,与仅两个 ATP 分子的水解有关。在这里,我们测量了当 Fe 蛋白簇处于 [4Fe-4S] 1+状态和处于 [4Fe-4S] 0状态时,在稳态催化下每次电子转移消耗的 ATP 数量状态。发现 Fe 蛋白的两种氧化态都通过为每个单电子转移事件水解两个 ATP 来运作。因此,无论其初始氧化还原状态如何,Fe 蛋白在需要水解两个 ATP 的过程中一次仅将一个电子转移到 MoFe 蛋白。

"点击查看英文标题和摘要"
更新日期:2023-03-01

"点击查看英文标题和摘要"


















































 京公网安备 11010802027423号
京公网安备 11010802027423号