当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
氨基酸字母的早期选择是根据可折叠性的生物物理限制自适应地形成的
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2023-02-24 , DOI: 10.1021/jacs.2c12987 Mikhail Makarov 1 , Alma C Sanchez Rocha 1 , Robin Krystufek 2, 3 , Ivan Cherepashuk 1 , Volha Dzmitruk 4 , Tatsiana Charnavets 4 , Anneliese M Faustino 5 , Michal Lebl 3 , Kosuke Fujishima 6, 7 , Stephen D Fried 5, 8 , Klara Hlouchova 1, 3
Affiliation
|
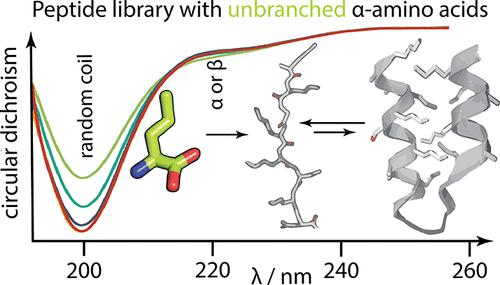
现代蛋白质依赖于 20 种经典氨基酸 (AA) 的准通用库,而大量证据表明古代蛋白质依赖于 10 种“早期”氨基酸的有限字母表,而 10 种“晚期”氨基酸是生物合成的产物途径。然而,许多非蛋白氨基酸也可在生命前获得,这就引出了两个基本问题:为什么我们有当前的现代氨基酸字母表?如果不同的氨基酸组成遗传密码,蛋白质是否也能够折叠成球状结构?在这里,我们通过实验评估了合成组合 25 聚肽文库中几种益生元相关氨基酸的溶解度和二级结构倾向。将生命前最丰富的线性脂肪族和碱性残基与其他早期氨基酸一起掺入或代替其他早期氨基酸,以探索这些替代序列空间。结果表明,可折叠性可能是选择规范字母表的关键因素。尽管它们的益生元丰度很高,但无支链脂肪族氨基酸仍被从蛋白质字母表中清除,因为它们产生过度溶解且包装效率低的多肽。令人惊讶的是,我们发现短链碱性氨基酸的包含也会降低多肽的二级结构潜力,为此我们提出了一个生物物理模型。我们的结果支持这样的观点,即尽管缺乏基本残基,早期的规范字母表在支持蛋白质折叠方面具有显着的适应性,并解释了为什么基本残基仅在蛋白质进化的后期阶段才被纳入。

"点击查看英文标题和摘要"





















































 京公网安备 11010802027423号
京公网安备 11010802027423号