Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
通过傅里叶变换红外吸收光谱法研究离子液体的水合状态:与蛋白质分子稳定化的相关性
Langmuir ( IF 3.7 ) Pub Date : 2023-02-08 , DOI: 10.1021/acs.langmuir.2c02851
Navin Rajapriya Inbaraj 1 , Subin Song 1 , Ryongsok Chang 1 , Kyoko Fujita 2 , Tomohiro Hayashi 1
Langmuir ( IF 3.7 ) Pub Date : 2023-02-08 , DOI: 10.1021/acs.langmuir.2c02851
Navin Rajapriya Inbaraj 1 , Subin Song 1 , Ryongsok Chang 1 , Kyoko Fujita 2 , Tomohiro Hayashi 1
Affiliation
|
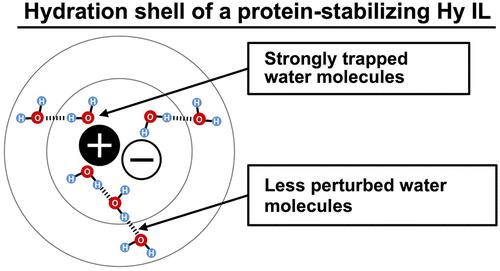
在多种离子液体中,一些水合离子液体 (Hy ILs) 表现出非凡的稳定蛋白质分子并长期保持其结构和功能的能力。然而,这些稳定蛋白质的 Hy IL 之间复杂的 IL-水相互作用尚未得到明确阐明。在这项工作中,我们从水化结构的角度研究了离子液体与蛋白质相容性的起源。我们使用傅立叶变换红外吸收 (FT-IR) 光谱系统地分析了离子液体周围水分子的氢键状态。我们发现水的天然氢键网络在稳定蛋白质的离子液体中保持相对不受干扰。我们还观察到,稳定蛋白质的离子液体与周围的水分子有很强的电场相互作用,这种水-离子液体相互作用不会破坏水-水氢键相互作用。另一方面,蛋白质变性离子液体在更大程度上扰乱了水分子的氢键网络。此外,发现蛋白质变性离子液体对水分子具有弱电场效应。我们推测离子液体与水分子的直接氢键结合以及离子的强电场持续数个水合壳层同时保持水分子的相对未受干扰的氢键网络在蛋白质稳定中起着重要作用。另一方面,蛋白质变性离子液体在更大程度上扰乱了水分子的氢键网络。此外,发现蛋白质变性离子液体对水分子具有弱电场效应。我们推测离子液体与水分子的直接氢键结合以及离子的强电场持续数个水合壳层同时保持水分子的相对未受干扰的氢键网络在蛋白质稳定中起着重要作用。另一方面,蛋白质变性离子液体在更大程度上扰乱了水分子的氢键网络。此外,发现蛋白质变性离子液体对水分子具有弱电场效应。我们推测离子液体与水分子的直接氢键结合以及离子的强电场持续数个水合壳层同时保持水分子的相对未受干扰的氢键网络在蛋白质稳定中起着重要作用。

"点击查看英文标题和摘要"
更新日期:2023-02-08

"点击查看英文标题和摘要"







































 京公网安备 11010802027423号
京公网安备 11010802027423号