当前位置:
X-MOL 学术
›
Colloids Surf. B Biointerfaces
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
靶向αvβ3受体的具有穿膜作用的KLA-RGD整合脂肽的研制及联合抗肿瘤应用
Colloids and Surfaces B: Biointerfaces ( IF 5.4 ) Pub Date : 2023-02-02 , DOI: 10.1016/j.colsurfb.2023.113186 Linhao Ma 1 , Mingcong Niu 1 , Yiping Ji 1 , Lu Liu 1 , XiuLian Gu 1 , Junlin Luo 1 , Guangcheng Wei 1 , Miaomiao Yan 1

"点击查看英文标题和摘要"
更新日期:2023-02-05
Colloids and Surfaces B: Biointerfaces ( IF 5.4 ) Pub Date : 2023-02-02 , DOI: 10.1016/j.colsurfb.2023.113186 Linhao Ma 1 , Mingcong Niu 1 , Yiping Ji 1 , Lu Liu 1 , XiuLian Gu 1 , Junlin Luo 1 , Guangcheng Wei 1 , Miaomiao Yan 1
Affiliation
|
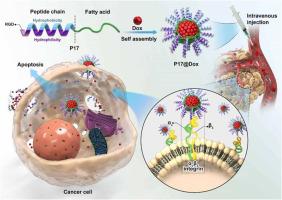
在此,基于KLA和RGD肽的整合合成了具有α-螺旋结构的两亲性阳离子抗癌脂肽P17,其可与整合素αvβ3受体结合. P17在水溶液中可以自组装成稳定的球形聚集体,包裹抗癌药物(如Dox)形成P17@抗癌药物纳米药物(P17@Dox nanomedicine),发挥P17与抗癌药物(Dox)的联合治疗作用). P17聚集体对Dox的包封率为80.4±3.2%,P17@Dox纳米药物的体外释放行为具有缓释和pH响应性特点。体外实验表明,P17脂肽具有低细胞毒性、高血清稳定性、低溶血和强穿膜能力。P17@Dox在细胞内释放Dox具有时间依赖性,P17@Dox纳米药物具有良好的抗癌作用。体内实验表明,P17和P17@Dox纳米药物均具有低溶血作用,P17@Dox纳米药物可有效抑制肿瘤生长,显着降低Dox的毒副作用。分子对接实验表明P17能与整合素α受体有效相互作用v β 3。综上所述,P17脂肽可作为优良的药物载体,发挥P17与抗癌药物的联合抗癌作用。

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号