当前位置:
X-MOL 学术
›
FEBS Open Bio
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
全长 RAD52 蛋白的冷冻电镜结构包含一个十一聚体环
FEBS Open Bio ( IF 2.8 ) Pub Date : 2023-01-27 , DOI: 10.1002/2211-5463.13565 Chiaki Kinoshita 1 , Yoshimasa Takizawa 2 , Mika Saotome 1 , Shun Ogino 1 , Hitoshi Kurumizaka 2 , Wataru Kagawa 1
FEBS Open Bio ( IF 2.8 ) Pub Date : 2023-01-27 , DOI: 10.1002/2211-5463.13565 Chiaki Kinoshita 1 , Yoshimasa Takizawa 2 , Mika Saotome 1 , Shun Ogino 1 , Hitoshi Kurumizaka 2 , Wataru Kagawa 1
Affiliation
|
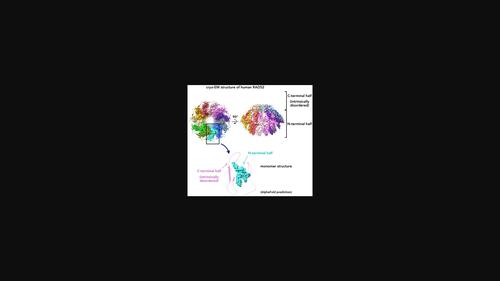
形成寡聚环结构的人 RAD52 蛋白参与 DNA 双链断裂修复。RAD52 的 N 端一半主要负责自身寡聚化和 DNA 结合。晶体学研究揭示了 N 端一半的详细结构。然而,全长蛋白质仅报道了低分辨率结构,因此 C 端一半在自寡聚化中的结构作用仍然难以捉摸。在这项研究中,我们通过冷冻电子显微镜 (cryo-EM) 确定了人 RAD52 蛋白的溶液结构,平均分辨率为 3.5 Å。该结构揭示了一个与 N 端一半的晶体结构几乎相同的十一聚体环。C 端一半的冷冻电镜图定义不明确,表明该区域本质上是无序的。目前的低温 EM 结构为 RAD52 的 N 端和 C 端半部分在 DNA 双链断裂修复过程中所发挥的机制作用提供了重要的见解。

"点击查看英文标题和摘要"
更新日期:2023-01-27

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号