当前位置:
X-MOL 学术
›
Adv. Funct. Mater.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Antioxidase-Like Nanobiocatalysts with Ultrafast and Reversible Redox-Centers to Secure Stem Cells and Periodontal Tissues
Advanced Functional Materials ( IF 18.5 ) Pub Date : 2023-01-22 , DOI: 10.1002/adfm.202211778
Jiusi Guo 1 , Zhenyu Xing 2 , Luchang Liu 2 , Yimin Sun 1 , Hongju Zhou 3 , Mingru Bai 1 , Xikui Liu 2 , Mohsen Adeli 4 , Chong Cheng 2, 5 , Xianglong Han 1, 5
Advanced Functional Materials ( IF 18.5 ) Pub Date : 2023-01-22 , DOI: 10.1002/adfm.202211778
Jiusi Guo 1 , Zhenyu Xing 2 , Luchang Liu 2 , Yimin Sun 1 , Hongju Zhou 3 , Mingru Bai 1 , Xikui Liu 2 , Mohsen Adeli 4 , Chong Cheng 2, 5 , Xianglong Han 1, 5
Affiliation
|
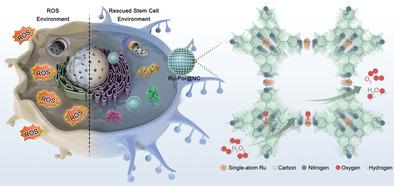
Exploration of efficient antioxidase-like reactive oxygen nanobiocatalysts (ROBCs) is a major challenge in combating oxidative stress-related diseases. Herein, the molecularly well-defined Ru-porphyrin-networks (Ru-Por-Net)-based ROBCs with ultrafast and reversible redox-centers for catalytic elimination of reactive oxygen species (ROS) are reported. Owing to the large π-conjugated networks, Ru–N coordination structures, and unique electronic and redox properties of atomic Ru sites, the Ru-Por-Net-based ROBCs exhibit exceptional catalytic ROS-scavenging activities. It is considerably more efficient than recently reported state-of-the-art anti-ROS biocatalysts. Notably, a new nucleophilic attack pathway to eliminate H2O2 and produce O2 is proposed via theoretical calculations, and the desorption of the OO* process is identified as the rate-determining step of atomic Ru centers. Cellular studies reveal that the new ROBCs can efficiently secure the survival, adhesion, spreading, and differentiation of the stem cells in high-ROS-level microenvironments. In vivo rat periodontitis treatments further demonstrate their superior anti-ROS therapeutic effects. This study provides significant insights into the crucial functions of Ru–N coordinated porphyrin-networks in catalytic ROS-scavenging and offers a new strategy to engineer high-performance antioxidase-like nanobiocatalysts for stem cell-based therapies and inflammatory diseases.
中文翻译:

具有超快和可逆氧化还原中心的类抗氧化酶纳米生物催化剂可保护干细胞和牙周组织
探索有效的类抗氧化酶活性氧纳米生物催化剂(ROBCs)是对抗氧化应激相关疾病的主要挑战。在此,报道了分子明确的基于 Ru-卟啉网络 (Ru-Por-Net) 的 ROBCs,具有超快和可逆的氧化还原中心,用于催化消除活性氧 (ROS)。由于大型 π 共轭网络、Ru-N 配位结构以及原子 Ru 位点独特的电子和氧化还原特性,基于 Ru-Por-Net 的 ROBC 表现出出色的催化 ROS 清除活性。它比最近报道的最先进的抗 ROS 生物催化剂更有效。值得注意的是,一种新的亲核攻击途径可以消除 H 2 O 2并产生 O 2通过理论计算提出,OO *过程的解吸被确定为原子Ru中心的速率决定步骤。细胞研究表明,新的 ROBCs 可以有效地确保干细胞在高 ROS 水平的微环境中的存活、粘附、扩散和分化。体内大鼠牙周炎治疗进一步证明了其优越的抗 ROS 治疗效果。这项研究提供了对 Ru-N 配位卟啉网络在催化 ROS 清除中的关键功能的重要见解,并提供了一种新策略来设计用于干细胞疗法和炎症性疾病的高性能抗氧化酶类纳米生物催化剂。
更新日期:2023-01-22
中文翻译:

具有超快和可逆氧化还原中心的类抗氧化酶纳米生物催化剂可保护干细胞和牙周组织
探索有效的类抗氧化酶活性氧纳米生物催化剂(ROBCs)是对抗氧化应激相关疾病的主要挑战。在此,报道了分子明确的基于 Ru-卟啉网络 (Ru-Por-Net) 的 ROBCs,具有超快和可逆的氧化还原中心,用于催化消除活性氧 (ROS)。由于大型 π 共轭网络、Ru-N 配位结构以及原子 Ru 位点独特的电子和氧化还原特性,基于 Ru-Por-Net 的 ROBC 表现出出色的催化 ROS 清除活性。它比最近报道的最先进的抗 ROS 生物催化剂更有效。值得注意的是,一种新的亲核攻击途径可以消除 H 2 O 2并产生 O 2通过理论计算提出,OO *过程的解吸被确定为原子Ru中心的速率决定步骤。细胞研究表明,新的 ROBCs 可以有效地确保干细胞在高 ROS 水平的微环境中的存活、粘附、扩散和分化。体内大鼠牙周炎治疗进一步证明了其优越的抗 ROS 治疗效果。这项研究提供了对 Ru-N 配位卟啉网络在催化 ROS 清除中的关键功能的重要见解,并提供了一种新策略来设计用于干细胞疗法和炎症性疾病的高性能抗氧化酶类纳米生物催化剂。


































 京公网安备 11010802027423号
京公网安备 11010802027423号