Redox Biology ( IF 10.7 ) Pub Date : 2023-01-07 , DOI: 10.1016/j.redox.2022.102598
Plamena R Angelova 1 , Isabella Myers 1 , Andrey Y Abramov 1
|
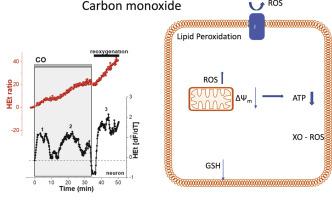
一氧化碳 (CO) 中毒是中毒死亡率和发病率的主要原因之一。我们研究了培养物中皮质神经元中活性氧的产生,以响应有毒剂量的 CO 暴露。荧光显微镜用于测量自由基生成、脂质过氧化、GSH 水平以及线粒体代谢的速率。我们发现,与缺血相比,从 CORM-401 释放的有毒浓度的 CO 诱导线粒体去极化和抑制 NADH 依赖性呼吸的程度较低。暴露于 CO 40 分钟内未观察到能量崩溃。我们发现,CO 会通过三种不同的机制诱导活性氧的产生,从而导致脂质过氧化和 GSH 减少:在暴露于 CO 的最初几分钟内来自线粒体,由于能量剥夺,在暴露约 20 分钟时来自黄嘌呤氧化酶,并且在 CO2 暴露期后(再氧化)NADPH 氧化酶产生大量 ROS。用线粒体抗氧化剂、黄嘌呤氧化酶抑制剂或 NADPH 氧化酶抑制这些不同阶段,保护神经元和星形胶质细胞免受 CO 诱导的氧化应激和细胞死亡。在 NADPH 氧化酶抑制过程中观察到最深远的影响。因此,氧化应激在 CO 诱导的神经元细胞死亡中具有非常重要的作用,并且在考虑对 CO 暴露的患者产生积极的神经保护性治疗结果时,防止其在再氧合过程中发生非常重要。以及在 CO2 暴露期(再氧化)后 NADPH 氧化酶产生大量 ROS。用线粒体抗氧化剂、黄嘌呤氧化酶抑制剂或 NADPH 氧化酶抑制这些不同阶段,保护神经元和星形胶质细胞免受 CO 诱导的氧化应激和细胞死亡。在 NADPH 氧化酶抑制过程中观察到最深远的影响。因此,氧化应激在 CO 诱导的神经元细胞死亡中具有非常重要的作用,并且在考虑对 CO 暴露的患者产生积极的神经保护性治疗结果时,防止其在再氧合过程中发生非常重要。以及在 CO2 暴露期(再氧化)后 NADPH 氧化酶产生大量 ROS。用线粒体抗氧化剂、黄嘌呤氧化酶抑制剂或 NADPH 氧化酶抑制这些不同阶段,保护神经元和星形胶质细胞免受 CO 诱导的氧化应激和细胞死亡。在 NADPH 氧化酶抑制过程中观察到最深远的影响。因此,氧化应激在 CO 诱导的神经元细胞死亡中具有非常重要的作用,并且在考虑对 CO 暴露的患者产生积极的神经保护性治疗结果时,防止其在再氧合过程中发生非常重要。保护神经元和星形胶质细胞免受 CO 诱导的氧化应激和细胞死亡。在 NADPH 氧化酶抑制过程中观察到最深远的影响。因此,氧化应激在 CO 诱导的神经元细胞死亡中具有非常重要的作用,并且在考虑对 CO 暴露的患者产生积极的神经保护性治疗结果时,防止其在再氧合过程中发生非常重要。保护神经元和星形胶质细胞免受 CO 诱导的氧化应激和细胞死亡。在 NADPH 氧化酶抑制过程中观察到最深远的影响。因此,氧化应激在 CO 诱导的神经元细胞死亡中具有非常重要的作用,并且在考虑对 CO 暴露的患者产生积极的神经保护性治疗结果时,防止其在再氧合过程中发生非常重要。

"点击查看英文标题和摘要"






































 京公网安备 11010802027423号
京公网安备 11010802027423号