当前位置:
X-MOL 学术
›
Pept. Sci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
温度诱导的整合素 αvβ3 受体结构变化及其与 RGD 肽配体的相互作用
Peptide Science ( IF 1.5 ) Pub Date : 2022-12-28 , DOI: 10.1002/pep2.24302 Anqi Wang 1, 2 , Kai Yue 1, 2 , Yiang Wei 1 , Weishen Zhong 1, 2 , Genpei Zhang 1, 2
Peptide Science ( IF 1.5 ) Pub Date : 2022-12-28 , DOI: 10.1002/pep2.24302 Anqi Wang 1, 2 , Kai Yue 1, 2 , Yiang Wei 1 , Weishen Zhong 1, 2 , Genpei Zhang 1, 2
Affiliation
|
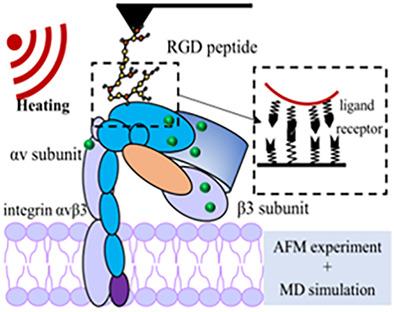
受体蛋白在高温下的结构变化是影响热疗和药物递送联合治疗的配体安装纳米载体靶向能力的因素之一。本研究从理论和实验两方面研究了整合素 αvβ3 受体与精氨酸-甘氨酸-天冬氨酸 (RGD) 肽配体在高温下的结合行为和机制。通过分子动力学模拟计算不同温度下整合素αvβ3的结构参数以及RGD肽与整合素αvβ3在不同结合位点的相互作用力。傅里叶变换红外光谱、能量色散光谱、紫外-可见吸收光谱、和原子力显微镜用于分析整合素 αvβ3 的结构变化并测量配体-受体相互作用。结果表明,随着温度的升高,整合素αvβ3的氢键数量减少,二级结构发生变化,表明整合素αvβ3发生了变性。整合素αv亚基在高温下的结构稳定性优于整合素β3亚基。随着温度升高,RGD 肽与整合素 αvβ3 之间的相互作用减弱,因为整合素 αvβ3 结合位点的结构变得更加灵活,并且相应的钙离子从结合位点脱落。

"点击查看英文标题和摘要"
更新日期:2022-12-28

"点击查看英文标题和摘要"





















































 京公网安备 11010802027423号
京公网安备 11010802027423号