Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
乳腺肿瘤微环境中 PFKFB4 的缺氧激活塑造代谢和细胞可塑性,从而增强转移能力
Cell Reports ( IF 7.5 ) Pub Date : 2022-12-06 , DOI: 10.1016/j.celrep.2022.111756 Tao Dai 1 , Spencer R Rosario 2 , Eriko Katsuta 1 , Abhisha Sawant Dessai 1 , Emily J Paterson 1 , Aaron T Novickis 1 , Eduardo Cortes Gomez 2 , Bokai Zhu 3 , Song Liu 2 , Hai Wang 4 , Scott I Abrams 5 , Mukund Seshadri 6 , Wiam Bshara 7 , Subhamoy Dasgupta 1

"点击查看英文标题和摘要"
更新日期:2022-12-06
Cell Reports ( IF 7.5 ) Pub Date : 2022-12-06 , DOI: 10.1016/j.celrep.2022.111756 Tao Dai 1 , Spencer R Rosario 2 , Eriko Katsuta 1 , Abhisha Sawant Dessai 1 , Emily J Paterson 1 , Aaron T Novickis 1 , Eduardo Cortes Gomez 2 , Bokai Zhu 3 , Song Liu 2 , Hai Wang 4 , Scott I Abrams 5 , Mukund Seshadri 6 , Wiam Bshara 7 , Subhamoy Dasgupta 1
Affiliation
|
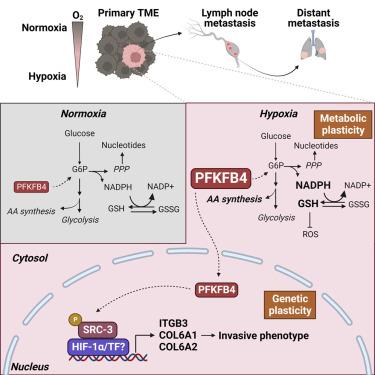
癌细胞遇到不利的肿瘤微环境(TME),它们对代谢应激的适应决定了转移能力。在这里,我们发现代谢酶 6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶-4 (PFKFB4) 在缺氧肿瘤中被诱导,获得代谢可塑性和侵袭表型。在乳腺癌小鼠模型中,PFKFB4 的基因消除显着延迟了远处器官转移,通过抑制包括整合素 β3 在内的侵入性基因特征的表达来减少局部淋巴结侵袭。光声成像和缺氧肿瘤的代谢组学分析表明,PFKFB4 驱动代谢灵活性,使活性氧快速解毒,有利于在选择压力下生存。从机制上讲,缺氧诱导会触发 PFKFB4 的核易位,从而加剧 HIF-1α 的非典型转录激活,并且发现肿瘤中核 PFKFB4 增加的乳腺癌患者与不良预后显着相关。我们的研究结果表明,PFKFB4 诱导对于缺氧 TME 中肿瘤细胞的适应至关重要,而缺氧 TME 决定了转移能力。

"点击查看英文标题和摘要"


















































 京公网安备 11010802027423号
京公网安备 11010802027423号