当前位置:
X-MOL 学术
›
Aging Cell
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
N-homocysteinylation of α-synuclein promotes its aggregation and neurotoxicity
Aging Cell ( IF 8.0 ) Pub Date : 2022-11-27 , DOI: 10.1111/acel.13745 Lingyan Zhou 1 , Tao Guo 1 , Lanxia Meng 1 , Xingyu Zhang 1 , Ye Tian 1 , Lijun Dai 1 , Xuan Niu 1 , Yiming Li 1 , Congcong Liu 1 , Guiqin Chen 1, 2 , Chaoyang Liu 1, 3 , Wei Ke 1 , Zhaohui Zhang 1 , Anyu Bao 4 , Zhentao Zhang 1, 5
Aging Cell ( IF 8.0 ) Pub Date : 2022-11-27 , DOI: 10.1111/acel.13745 Lingyan Zhou 1 , Tao Guo 1 , Lanxia Meng 1 , Xingyu Zhang 1 , Ye Tian 1 , Lijun Dai 1 , Xuan Niu 1 , Yiming Li 1 , Congcong Liu 1 , Guiqin Chen 1, 2 , Chaoyang Liu 1, 3 , Wei Ke 1 , Zhaohui Zhang 1 , Anyu Bao 4 , Zhentao Zhang 1, 5
Affiliation
|
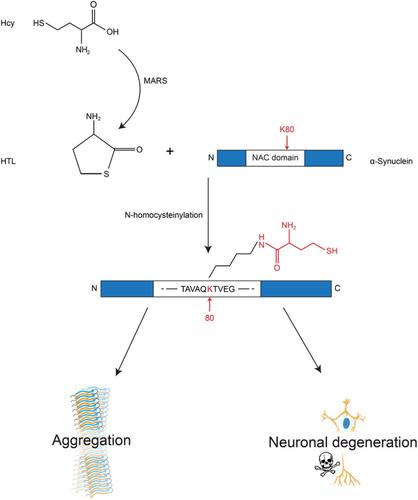
The aggregation of α-synuclein plays a pivotal role in the pathogenesis of Parkinson's disease (PD). Epidemiological evidence indicates that high level of homocysteine (Hcy) is associated with an increased risk of PD. However, the molecular mechanisms remain elusive. Here, we report that homocysteine thiolactone (HTL), a reactive thioester of Hcy, covalently modifies α-synuclein on the K80 residue. The levels of α-synuclein K80Hcy in the brain are increased in an age-dependent manner in the TgA53T mice, correlating with elevated levels of Hcy and HTL in the brain during aging. The N-homocysteinylation of α-synuclein stimulates its aggregation and forms fibrils with enhanced seeding activity and neurotoxicity. Intrastriatal injection of homocysteinylated α-synuclein fibrils induces more severe α-synuclein pathology and motor deficits when compared with unmodified α-synuclein fibrils. Increasing the levels of Hcy aggravates α-synuclein neuropathology in a mouse model of PD. In contrast, blocking the N-homocysteinylation of α-synuclein ameliorates α-synuclein pathology and degeneration of dopaminergic neurons. These findings suggest that the covalent modification of α-synuclein by HTL promotes its aggregation. Targeting the N-homocysteinylation of α-synuclein could be a novel therapeutic strategy against PD.
中文翻译:

α-突触核蛋白的 N-同型半胱氨酸化促进其聚集和神经毒性
α-突触核蛋白的聚集在帕金森病 (PD) 的发病机制中起着关键作用。流行病学证据表明,高水平的同型半胱氨酸 (Hcy) 与 PD 风险增加有关。然而,分子机制仍然难以捉摸。在这里,我们报告了同型半胱氨酸硫内酯 (HTL),一种 Hcy 的反应性硫酯,共价修饰 K80 残基上的 α-突触核蛋白。在 TgA53T 小鼠中,大脑中 α-突触核蛋白 K80Hcy 的水平以年龄依赖性方式增加,与衰老过程中大脑中 Hcy 和 HTL 水平升高相关。α-突触核蛋白的 N-同型半胱氨酰化刺激其聚集并形成具有增强的播种活性和神经毒性的原纤维。与未修饰的 α-突触核蛋白原纤维相比,纹状体内注射同型半胱氨酰化 α-突触核蛋白原纤维会诱导更严重的 α-突触核蛋白病理学和运动缺陷。增加 Hcy 水平会加重 PD 小鼠模型中的 α-突触核蛋白神经病理学。相反,阻断 α-突触核蛋白的 N-同型半胱氨酰化可改善 α-突触核蛋白病理学和多巴胺能神经元的退化。这些发现表明,HTL 对 α-突触核蛋白的共价修饰促进了其聚集。靶向 α-突触核蛋白的 N-同型半胱氨酰化可能是一种新的抗 PD 治疗策略。阻断 α-突触核蛋白的 N-同型半胱氨酸化可改善 α-突触核蛋白病理学和多巴胺能神经元的退化。这些发现表明,HTL 对 α-突触核蛋白的共价修饰促进了其聚集。靶向 α-突触核蛋白的 N-同型半胱氨酰化可能是一种新的抗 PD 治疗策略。阻断 α-突触核蛋白的 N-同型半胱氨酸化可改善 α-突触核蛋白病理学和多巴胺能神经元的退化。这些发现表明,HTL 对 α-突触核蛋白的共价修饰促进了其聚集。靶向 α-突触核蛋白的 N-同型半胱氨酰化可能是一种新的抗 PD 治疗策略。
更新日期:2022-11-27
中文翻译:

α-突触核蛋白的 N-同型半胱氨酸化促进其聚集和神经毒性
α-突触核蛋白的聚集在帕金森病 (PD) 的发病机制中起着关键作用。流行病学证据表明,高水平的同型半胱氨酸 (Hcy) 与 PD 风险增加有关。然而,分子机制仍然难以捉摸。在这里,我们报告了同型半胱氨酸硫内酯 (HTL),一种 Hcy 的反应性硫酯,共价修饰 K80 残基上的 α-突触核蛋白。在 TgA53T 小鼠中,大脑中 α-突触核蛋白 K80Hcy 的水平以年龄依赖性方式增加,与衰老过程中大脑中 Hcy 和 HTL 水平升高相关。α-突触核蛋白的 N-同型半胱氨酰化刺激其聚集并形成具有增强的播种活性和神经毒性的原纤维。与未修饰的 α-突触核蛋白原纤维相比,纹状体内注射同型半胱氨酰化 α-突触核蛋白原纤维会诱导更严重的 α-突触核蛋白病理学和运动缺陷。增加 Hcy 水平会加重 PD 小鼠模型中的 α-突触核蛋白神经病理学。相反,阻断 α-突触核蛋白的 N-同型半胱氨酰化可改善 α-突触核蛋白病理学和多巴胺能神经元的退化。这些发现表明,HTL 对 α-突触核蛋白的共价修饰促进了其聚集。靶向 α-突触核蛋白的 N-同型半胱氨酰化可能是一种新的抗 PD 治疗策略。阻断 α-突触核蛋白的 N-同型半胱氨酸化可改善 α-突触核蛋白病理学和多巴胺能神经元的退化。这些发现表明,HTL 对 α-突触核蛋白的共价修饰促进了其聚集。靶向 α-突触核蛋白的 N-同型半胱氨酰化可能是一种新的抗 PD 治疗策略。阻断 α-突触核蛋白的 N-同型半胱氨酸化可改善 α-突触核蛋白病理学和多巴胺能神经元的退化。这些发现表明,HTL 对 α-突触核蛋白的共价修饰促进了其聚集。靶向 α-突触核蛋白的 N-同型半胱氨酰化可能是一种新的抗 PD 治疗策略。































 京公网安备 11010802027423号
京公网安备 11010802027423号