当前位置:
X-MOL 学术
›
J. Agric. Food Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
基质金属蛋白酶 1 和金属蛋白酶组织抑制剂与盘鲍胶原代谢的关系
Journal of Agricultural and Food Chemistry ( IF 5.7 ) Pub Date : 2022-11-18 , DOI: 10.1021/acs.jafc.2c05931
Yu-Lei Chen 1, 2 , Ming-Hui Zhang 1 , Le-Le Su 1 , Le-Chang Sun 1, 2 , Xu-Jian Qiu 1 , Duanquan Lin 1, 2 , Ling-Jing Zhang 1, 2 , Tengchuan Jin 3 , Min-Jie Cao 1, 2
Journal of Agricultural and Food Chemistry ( IF 5.7 ) Pub Date : 2022-11-18 , DOI: 10.1021/acs.jafc.2c05931
Yu-Lei Chen 1, 2 , Ming-Hui Zhang 1 , Le-Le Su 1 , Le-Chang Sun 1, 2 , Xu-Jian Qiu 1 , Duanquan Lin 1, 2 , Ling-Jing Zhang 1, 2 , Tengchuan Jin 3 , Min-Jie Cao 1, 2
Affiliation
|
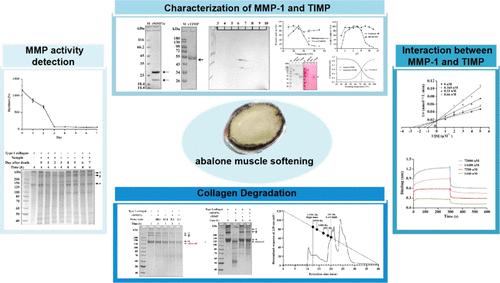
为了响应物理、化学和/或生物刺激,鲍鱼会发生相当大的组织自降解,导致严重的收获后质量损失。在此过程中,细胞外基质 (ECM) 被内源性蛋白酶大大降解。ECM 的主要成分是胶原蛋白,主要是 I 型胶原蛋白。虽然可以特异性降解胶原蛋白的基质金属蛋白酶(MMPs)的活性受到MPs组织抑制剂(TIMPs)的精确调节,表明MMPs和TIMPs在组织自降解的调节中起着至关重要的作用,但很少有研究报道MMP 和 TIMP 之间的相互作用。在这项研究中,我们揭示了胶原酶参与Haliotis discus hannai的死后组织自我降解通过降解 I 型胶原蛋白。利用原核表达系统表达了具有高纯度和酶活性的重组鲍鱼MMP-1催化结构域(rMMP1c)。rMMP1c 的最适温度和 pH 值分别为 37 °C 和 7.0。rMMP1c 的热变性温度为 67.0 ± 0.9 °C。乙二胺四乙酸(EDTA)和1,10-菲咯啉可完全抑制rMMP1c活性,而Ba 2+、Ca 2+和Mg 2+可以显着提升它。TIMP 也使用 HEK 293F 细胞表达。重组 TIMP (rTIMP) 对 rMMP1c 显示出良好的抑制活性。抑制动力学分析表明 rTIMP 是 rMMP1c 的竞争性抑制剂。生物层干涉测量显示 rTIMP 可以有效地与 rMMP1c 结合,平衡解离常数值为 263 nM。rMMP1c依次有效降解I型胶原γ-β-α链,rTIMP可显着抑制rMMP1c降解活性。这些结果为研究MMP与TIMP相互作用提供了理论基础,阐明了鲍鱼组织自降解的可能机制。

"点击查看英文标题和摘要"
更新日期:2022-11-18

"点击查看英文标题和摘要"







































 京公网安备 11010802027423号
京公网安备 11010802027423号