当前位置:
X-MOL 学术
›
Anal. Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
使用在大肠杆菌中表达的可光活化抗体Fc结合蛋白对抗体进行共价和定向表面固定
Analytical Chemistry ( IF 6.7 ) Pub Date : 2016-09-14 00:00:00 , DOI: 10.1021/acs.analchem.6b02071 Yeolin Lee 1 , Jiyun Jeong 1 , Gabi Lee 1 , Jeong Hee Moon 1 , Myung Kyu Lee 1
Analytical Chemistry ( IF 6.7 ) Pub Date : 2016-09-14 00:00:00 , DOI: 10.1021/acs.analchem.6b02071 Yeolin Lee 1 , Jiyun Jeong 1 , Gabi Lee 1 , Jeong Hee Moon 1 , Myung Kyu Lee 1
Affiliation
|
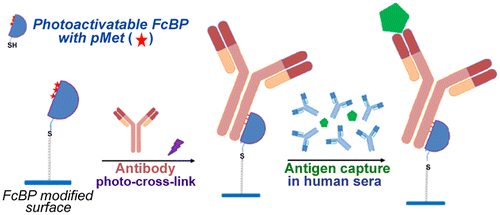
具有蛋白G最小结构域的Fc特异性抗体结合蛋白(FcBP)被广泛用于将定向良好的抗体固定在固体表面上,但是与FcBPs的非共价结合的抗体在含有大量抗体的血清中不稳定。在这里,我们报告新型光活化的FcBPs与在大肠杆菌中表达的光甲硫氨酸(pMet),在紫外线照射下与抗体诱导Fc特异性光交联。不幸的是,pMet不支持天然大肠杆菌系统中的蛋白质表达,因此我们还开发了一种工程化的甲硫氨酰tRNA合成酶(MRS5m)。在甲硫氨酸营养缺陷型大肠杆菌中,MRS5m蛋白的共表达成功诱导了可光激活的FcBP过表达。细胞。可光活化的FcBP可以通过其N端半胱氨酸残基和6xHis标签轻松固定在珠子和载玻片上。光交联到可光激活的FcBP磁珠上的抗体可抵抗血清抗体介导的解离,并有效捕获人血清中的抗原。此外,使用该系统制备的光交联抗体阵列可通过夹心免疫测定法灵敏地检测人血清中的抗原。可光活化的FcBP将广泛应用于微流控芯片,载玻片和纳米珠的各种表面上的定向抗体固定,这是开发灵敏免疫传感器所必需的。

"点击查看英文标题和摘要"
更新日期:2016-09-14

"点击查看英文标题和摘要"





















































 京公网安备 11010802027423号
京公网安备 11010802027423号