当前位置:
X-MOL 学术
›
J. Phys. Chem. B
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
TMAO和压力对TrpCage折叠平衡的影响
The Journal of Physical Chemistry B ( IF 2.8 ) Pub Date : 2022-10-17 , DOI: 10.1021/acs.jpcb.2c04034
Angelina Folberth 1 , Nico F A van der Vegt 1
The Journal of Physical Chemistry B ( IF 2.8 ) Pub Date : 2022-10-17 , DOI: 10.1021/acs.jpcb.2c04034
Angelina Folberth 1 , Nico F A van der Vegt 1
Affiliation
|
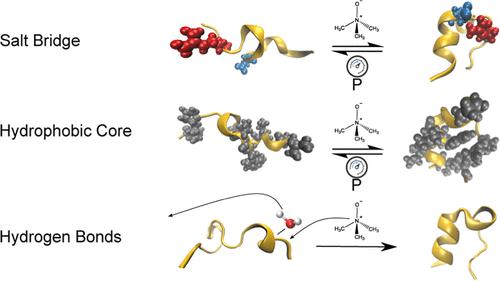
三甲胺-N-氧化物 (TMAO) 是一种渗透剂,以其抵消蛋白质压力变性的能力而闻名。然而,解决 TMAO 渗透作用分子机制的计算研究只关注其在环境压力下的蛋白质稳定特性,而忽略了在高压条件下 TMAO 的水合结构改变为水结合增加的结构可能发生的变化。在这里,我们提出了关于压力和 TMAO 对微型蛋白质 TrpCage 的综合影响的第一项研究。结果表明,在高压下,非极性残基堆积不紧密,TrpCage 的盐桥不稳定。这种效应被 TMAO 减轻了,TMAO 被发现在 1 kbar 比在 1 bar 环境压力下从蛋白质/水界面强烈耗尽,从而抵消了折叠自由能中升高的压力在热力学上的不利影响。TMAO 从带电基团(如形成盐桥的基团)中耗尽,并在疏水基团周围积累。尽管如此,它还是稳定了两种相互作用。此外,在 TMAO 存在的情况下,热焓有利的 TrpCage-水氢键减少,导致展开状态比折叠状态更不稳定。这使蛋白质折叠平衡向折叠状态移动。因此,TMAO对不同种类的基团表现出稳定作用,在高压下部分增强。它稳定了两种相互作用。此外,在 TMAO 存在的情况下,热焓有利的 TrpCage-水氢键减少,导致展开状态比折叠状态更不稳定。这使蛋白质折叠平衡向折叠状态移动。因此,TMAO对不同种类的基团表现出稳定作用,在高压下部分增强。它稳定了两种相互作用。此外,在 TMAO 存在的情况下,热焓有利的 TrpCage-水氢键减少,导致展开状态比折叠状态更不稳定。这使蛋白质折叠平衡向折叠状态移动。因此,TMAO对不同种类的基团表现出稳定作用,在高压下部分增强。

"点击查看英文标题和摘要"
更新日期:2022-10-17

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号