当前位置:
X-MOL 学术
›
ACS Med. Chem. Lett.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Development of an N-Terminal BRD4 Bromodomain-Targeted Degrader
ACS Medicinal Chemistry Letters ( IF 3.5 ) Pub Date : 2022-09-29 , DOI: 10.1021/acsmedchemlett.2c00300 Anand Divakaran 1 , Cole R Scholtz 2 , Huda Zahid 2 , Wenwei Lin 3 , Elizabeth C Griffith 3 , Richard E Lee 3 , Taosheng Chen 3 , Daniel A Harki 1, 2 , William C K Pomerantz 1, 2
ACS Medicinal Chemistry Letters ( IF 3.5 ) Pub Date : 2022-09-29 , DOI: 10.1021/acsmedchemlett.2c00300 Anand Divakaran 1 , Cole R Scholtz 2 , Huda Zahid 2 , Wenwei Lin 3 , Elizabeth C Griffith 3 , Richard E Lee 3 , Taosheng Chen 3 , Daniel A Harki 1, 2 , William C K Pomerantz 1, 2
Affiliation
|
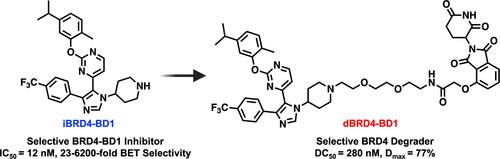
Targeted protein degradation is a powerful induced-proximity tool to control cellular protein concentrations using small molecules. However, the design of selective degraders remains empirical. Among bromodomain and extra-terminal (BET) family proteins, BRD4 is the primary therapeutic target over family members BRD2/3/T. Existing strategies for selective BRD4 degradation use pan-BET inhibitors optimized for BRD4:E3 ubiquitin ligase (E3) ternary complex formation, but these result in residual inhibition of undegraded BET-bromodomains by the pan-BET ligand, obscuring BRD4-degradation phenotypes. Using our selective inhibitor of the first BRD4 bromodomain, iBRD4-BD1 (IC50 = 12 nM, 23- to 6200-fold intra-BET selectivity), we developed dBRD4-BD1 to selectively degrade BRD4 (DC50 = 280 nM). Notably, dBRD4-BD1 upregulates BRD2/3, a result not observed with degraders using pan-BET ligands. Designing BRD4 selectivity up front enables analysis of BRD4 biology without wider BET-inhibition and simplifies designing BRD4-selective heterobifunctional molecules, such as degraders with new E3 recruiting ligands or for additional probes beyond degraders.
中文翻译:

N 端 BRD4 溴结构域靶向降解剂的开发
靶向蛋白质降解是一种强大的诱导邻近工具,可使用小分子控制细胞蛋白质浓度。然而,选择性降解器的设计仍然是经验性的。在溴结构域和额外末端 (BET) 家族蛋白中,BRD4 是家族成员 BRD2/3/T 的主要治疗靶点。现有的选择性 BRD4 降解策略使用针对 BRD4:E3 泛素连接酶 (E3) 三元复合物形成进行优化的泛 BET 抑制剂,但这会导致泛 BET 配体对未降解的 BET 溴结构域产生残留抑制,从而掩盖了 BRD4 降解表型。使用我们的第一个 BRD4 溴结构域的选择性抑制剂iBRD4-BD1(IC 50 = 12 nM,23 至 6200 倍的 BET 内选择性),我们开发了dBRD4-BD1来选择性降解 BRD4(DC 50 = 280 nM)。值得注意的是,dBRD4-BD1上调 BRD2/3,这是使用泛 BET 配体的降解剂未观察到的结果。预先设计 BRD4 选择性可以在没有更广泛的 BET 抑制的情况下分析 BRD4 生物学,并简化设计 BRD4 选择性异双功能分子,例如具有新 E3 募集配体的降解剂或除降解剂之外的其他探针。
更新日期:2022-09-29
中文翻译:

N 端 BRD4 溴结构域靶向降解剂的开发
靶向蛋白质降解是一种强大的诱导邻近工具,可使用小分子控制细胞蛋白质浓度。然而,选择性降解器的设计仍然是经验性的。在溴结构域和额外末端 (BET) 家族蛋白中,BRD4 是家族成员 BRD2/3/T 的主要治疗靶点。现有的选择性 BRD4 降解策略使用针对 BRD4:E3 泛素连接酶 (E3) 三元复合物形成进行优化的泛 BET 抑制剂,但这会导致泛 BET 配体对未降解的 BET 溴结构域产生残留抑制,从而掩盖了 BRD4 降解表型。使用我们的第一个 BRD4 溴结构域的选择性抑制剂iBRD4-BD1(IC 50 = 12 nM,23 至 6200 倍的 BET 内选择性),我们开发了dBRD4-BD1来选择性降解 BRD4(DC 50 = 280 nM)。值得注意的是,dBRD4-BD1上调 BRD2/3,这是使用泛 BET 配体的降解剂未观察到的结果。预先设计 BRD4 选择性可以在没有更广泛的 BET 抑制的情况下分析 BRD4 生物学,并简化设计 BRD4 选择性异双功能分子,例如具有新 E3 募集配体的降解剂或除降解剂之外的其他探针。































 京公网安备 11010802027423号
京公网安备 11010802027423号