当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Targeted Protein Degradation by Electrophilic PROTACs that Stereoselectively and Site-Specifically Engage DCAF1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2022-09-28 , DOI: 10.1021/jacs.2c08964
Yongfeng Tao 1 , David Remillard 1 , Ekaterina V Vinogradova 1 , Minoru Yokoyama 1 , Sofia Banchenko 2 , David Schwefel 2 , Bruno Melillo 1, 3 , Stuart L Schreiber 3, 4 , Xiaoyu Zhang 1 , Benjamin F Cravatt 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2022-09-28 , DOI: 10.1021/jacs.2c08964
Yongfeng Tao 1 , David Remillard 1 , Ekaterina V Vinogradova 1 , Minoru Yokoyama 1 , Sofia Banchenko 2 , David Schwefel 2 , Bruno Melillo 1, 3 , Stuart L Schreiber 3, 4 , Xiaoyu Zhang 1 , Benjamin F Cravatt 1
Affiliation
|
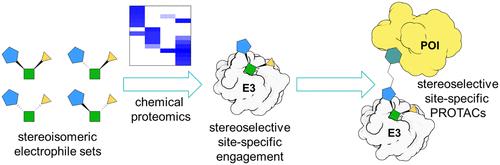
Targeted protein degradation induced by heterobifunctional compounds and molecular glues presents an exciting avenue for chemical probe and drug discovery. To date, small-molecule ligands have been discovered for only a limited number of E3 ligases, which is an important limiting factor for realizing the full potential of targeted protein degradation. We report herein the discovery by chemical proteomics of azetidine acrylamides that stereoselectively and site-specifically react with a cysteine (C1113) in the E3 ligase substrate receptor DCAF1. We demonstrate that the azetidine acrylamide ligands for DCAF1 can be developed into electrophilic proteolysis-targeting chimeras (PROTACs) that mediated targeted protein degradation in human cells. We show that this process is stereoselective and does not occur in cells expressing a C1113A mutant of DCAF1. Mechanistic studies indicate that only low fractional engagement of DCAF1 is required to support protein degradation by electrophilic PROTACs. These findings, taken together, demonstrate how the chemical proteomic analysis of stereochemically defined electrophilic compound sets can uncover ligandable sites on E3 ligases that support targeted protein degradation.
中文翻译:

通过立体选择性和位点特异性结合 DCAF1 的亲电 PROTAC 进行靶向蛋白质降解
由异双功能化合物和分子胶诱导的靶向蛋白质降解为化学探针和药物发现提供了令人兴奋的途径。迄今为止,仅发现了有限数量的 E3 连接酶的小分子配体,这是实现靶向蛋白质降解的全部潜力的重要限制因素。我们在此报告了通过化学蛋白质组学发现的氮杂环丁烷丙烯酰胺,其与 E3 连接酶底物受体 DCAF1 中的半胱氨酸 (C1113) 进行立体选择性和位点特异性反应。我们证明 DCAF1 的氮杂环丁烷丙烯酰胺配体可以开发成亲电蛋白水解靶向嵌合体 (PROTAC),介导人类细胞中的靶向蛋白质降解。我们证明这个过程是立体选择性的,并且不会发生在表达 DCAF1 的 C1113A 突变体的细胞中。机理研究表明,仅需要 DCAF1 的低比例参与即可支持亲电 PROTAC 的蛋白质降解。这些发现综合起来证明了立体化学定义的亲电子化合物组的化学蛋白质组学分析如何能够发现 E3 连接酶上支持靶向蛋白质降解的配位位点。
更新日期:2022-09-28
中文翻译:

通过立体选择性和位点特异性结合 DCAF1 的亲电 PROTAC 进行靶向蛋白质降解
由异双功能化合物和分子胶诱导的靶向蛋白质降解为化学探针和药物发现提供了令人兴奋的途径。迄今为止,仅发现了有限数量的 E3 连接酶的小分子配体,这是实现靶向蛋白质降解的全部潜力的重要限制因素。我们在此报告了通过化学蛋白质组学发现的氮杂环丁烷丙烯酰胺,其与 E3 连接酶底物受体 DCAF1 中的半胱氨酸 (C1113) 进行立体选择性和位点特异性反应。我们证明 DCAF1 的氮杂环丁烷丙烯酰胺配体可以开发成亲电蛋白水解靶向嵌合体 (PROTAC),介导人类细胞中的靶向蛋白质降解。我们证明这个过程是立体选择性的,并且不会发生在表达 DCAF1 的 C1113A 突变体的细胞中。机理研究表明,仅需要 DCAF1 的低比例参与即可支持亲电 PROTAC 的蛋白质降解。这些发现综合起来证明了立体化学定义的亲电子化合物组的化学蛋白质组学分析如何能够发现 E3 连接酶上支持靶向蛋白质降解的配位位点。

































 京公网安备 11010802027423号
京公网安备 11010802027423号