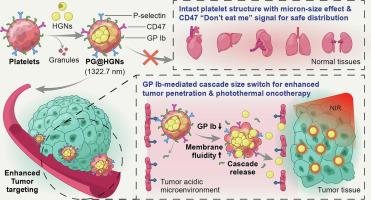
尽管纳米级药物递送系统 (NDDS) 在肿瘤学领域具有巨大的治疗潜力,但由于它们容易通过广泛的血管内皮间隙(高达 1 μm)发生脱靶积累,因此它们的肿瘤靶向效率和安全性仍然是主要挑战。为了解决这个问题,在这项研究中,微型细胞血小板“幽灵”(PGs,1.32 μm,没有内部颗粒和凝固的血小板)被用作载体来运送空心金纳米颗粒(HGNs,58.7 nm),形成一个分层的生物安全系统 (PG@HGNs) 减少正常组织拦截并增强 HGNs 的肿瘤靶向递送,以改善光热疗法。PGs是通过优化的“溶胀-挤压-洗脱”方法制备的,体外和体内。在体外在刺激肿瘤血管酸性微环境 (pH = 6.5) 的条件下,PG@HGNs 通过下调 PGs 上表达的糖蛋白 Ib 表现出增强的膜流动性。这种变化诱导了纳米级 HGN 的爆发释放,这些 HGN 能够在肿瘤-内皮细胞 transwell 模型上穿过血管内皮层,同时截获了微米级 PG 载体。与纳米级血小板膜包被载体 (PM@HGNs) 相比,PG@HGNs 对 4T1 细胞表现出增强的内化和细胞毒性。在动物模型中,PG@HGNs 显着延长循环很可能是由于 PGs 的“自我识别”受体 CD47 的存在,并有效地减少了正常组织的拦截微尺度尺寸效应。这些都有助于显着提高 HGN 的肿瘤靶向效率。与 PM@HGNs 相比,PG@HGNs 在动物身上产生了更大的抗肿瘤光热功效和安全性。总的来说,这项研究证明了配备调整膜 GP Ib 的微型 PG 作为 HGN 或其他可能的纳米药物的生物安全载体的潜力。
意义的陈述
尽管具有巨大的治疗潜力,但纳米级药物递送系统 (NDDS) 的安全性和肿瘤靶向效率因其在具有广泛血管内皮间隙的正常组织中的不良积累而受到损害,例如许多肿瘤靶向 NDDS 仍在肝脏中大量积累和/或脾脏。在此,我们探索了一种微纳米仿生级联递送系统来解决上述缺点。通过形成分级生物安全系统,微型血小板“幽灵”(PGs,1.32 μm)被用作肿瘤靶向递送载体来运输空心金纳米颗粒(HGNs,58.7 nm)。事实证明,这种微型系统可以维持血小板膜结构,从而在体内延长循环,同时避免外渗到正常组织中。PG@HGNs可通过下调糖蛋白Ib敏感响应肿瘤血管附近的酸性微环境,并快速释放“纳米子弹”-HGNs,通过EPR效应进一步渗透到肿瘤组织中,从而增强HGNs在NIR下产生的光热效应辐照。总的来说,微型 PG 可能是生物安全载体,用于改进 HGN 或其他可能的纳米药物的肿瘤靶向递送。
 "点击查看英文标题和摘要"
"点击查看英文标题和摘要"
Glycoprotein Ib-regulated micro platelet ghost for biosafe distribution and photothermal oncotherapy
Despite the tremendous theranostics potential of nano-scale drug delivery system (NDDS) in oncology field, their tumor-targeting efficiency and safety remain major challenges due to their proneness of off-target accumulation through widespread vascular endothelial gaps (up to 1 μm). To address this problem, in this research, micro-sized cellular platelet “ghosts” (PGs, 1.32 μm, platelet without inner granules and coagulation) were employed as carriers to ship hollow gold nanoparticles (HGNs, 58.7 nm), forming a hierarchical biosafe system (PG@HGNs) to reduce normal tissue interception and enhance tumor targeting delivery of HGNs for improved photothermal therapy. PGs were prepared by an optimized “swelling-extrusion-elution” method, HGNs were loaded in PGs (PG@HGNs) through a “hypotonic dialysis” method and the safety and biodistribution of the system was evaluated in vitro and in vivo. In in vitro condition that stimulated the tumoral vessel acidic microenvironment (pH = 6.5), PG@HGNs were demonstrated with enhanced membrane fluidity through down-regulation of the glycoprotein Ib expressed on the PGs. This change induced a burst release of nano-sized HGNs which were capable to traverse vascular endothelium layer on a tumor-endothelial cell transwell model, whilst the micro-sized PG carriers were intercepted. In comparison to nano-sized platelet membrane-coated carriers (PM@HGNs), PG@HGNs showed enhanced internalization and cytotoxicity to 4T1 cells. In animal models, PG@HGNs remarkably prolonged circulation most likely due to the presence of “self-recognition” receptor-CD47 of PGs, and effectively reduced normal tissue interception via the micro-scale size effect. These both contributed to the significantly improved tumor targeting efficiency of HGNs. PG@HGNs generated the greater antitumor photothermal efficacy alongside safety in the animals compared to PM@HGNs. Collectively, this study demonstrated the potential of the micro-scale PGs equipped with adjusted membrane GP Ib as biosafe vehicles for HGNs or possibly other nanodrugs.
The statement of significance
Despite the tremendous theranostics potentials, the safety and tumor-targeting efficiency of nano-scale drug delivery systems (NDDS) are compromised by their undesirable accumulation in normal tissues with widespread vascular endothelial gaps, such as many tumor-targeted NDDSs still accumulated much in liver and/or spleen. Herein, we explored a micro-nano biomimetic cascade delivery system to address the above drawbacks. By forming a hierarchical biosafe system, micro-sized platelet “ghost” (PGs, 1.32 μm) was employed as tumor-targeted delivery carrier to transport hollow gold nanoparticles (HGNs, 58.7 nm). It was demonstrated that this micro-size system could maintain platelet membrane structure thus prolong in vivo circulation, while avoiding extravasation into normal tissues. PG@HGNs could sensitively respond to the acidic microenvironment near tumor vessel via down-regulation of glycoprotein Ib and rapidly release “nano-bullets”-HGNs to further penetrate into the tumor tissues through EPR effect, thus enhancing photothermal efficacy generated by HGNs under NIR irradiation. Collectively, the micro-scaled PGs could be biosafe vehicles for improved tumor-targeted delivery of HGNs or possibly other nanodrugs.















































 京公网安备 11010802027423号
京公网安备 11010802027423号