当前位置:
X-MOL 学术
›
Luminescence
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Interactions between hydroxylated polycyclic aromatic hydrocarbons and serum albumins: multispectral and molecular docking analyses
Luminescence ( IF 3.2 ) Pub Date : 2022-09-13 , DOI: 10.1002/bio.4384
Meng-Shuo Li 1 , Jing Zhang 2 , Ya-Xian Zhu 3 , Yong Zhang 1
Luminescence ( IF 3.2 ) Pub Date : 2022-09-13 , DOI: 10.1002/bio.4384
Meng-Shuo Li 1 , Jing Zhang 2 , Ya-Xian Zhu 3 , Yong Zhang 1
Affiliation
|
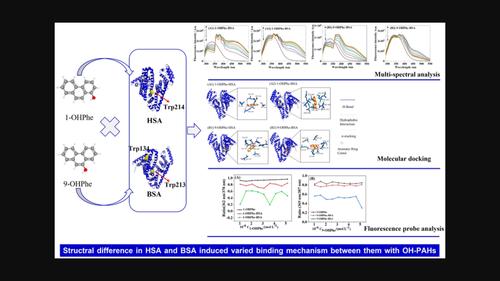
Hydroxylated polycyclic aromatic hydrocarbons (OH-PAHs) can bind to serum albumin and influence their distribution and elimination in organisms. Here, multispectral analysis and molecular docking methods were used to investigate the binding mechanism of two OH-PAHs, 1-hydroxyphenanthrene (1-OHPhe) and 9-hydroxyphenanthrene (9-OHPhe), with two homologous serum albumins, human serum albumin (HSA) and bovine serum albumin (BSA). The quenching constants of HSA with 1-OHPhe and 9-OHPhe were much larger than those for BSA. Energy transfer from the tryptophan (Trp) residues in HSA to 1-OHPhe and 9-OHPhe was more probable than from Trp in BSA. The interactions of 1-OHPhe and 9-OHPhe with Trp in HSA and BSA altered the microenvironment of Trp. Molecular docking results revealed that the binding modes and binding forces of 1-OHPhe and 9-OHPhe with HSA and BSA were different. The two OH-PAHs were used as fluorescent probes to analyze the microenvironmental hydrophobicities of HSA and BSA, which were distinctly different. The structural difference between HSA and BSA induced significant variations in their binding behaviour with 1-OHPhe and 9-OHPhe. Moreover, HSA was more susceptible to 1-OHPhe and 9-OHPhe than BSA. This work suggests that the differences between the two serum albumins should be considered in related studies.
中文翻译:

羟基化多环芳烃与血清白蛋白的相互作用:多光谱和分子对接分析
羟基化多环芳烃 (OH-PAHs) 可以与血清白蛋白结合并影响它们在生物体内的分布和消除。在这里,多光谱分析和分子对接方法用于研究两种 OH-PAHs,1-羟基菲 (1-OHPhe) 和 9-羟基菲 (9-OHPhe) 与两种同源血清白蛋白,人血清白蛋白 (HSA) 的结合机制。 ) 和牛血清白蛋白 (BSA)。具有 1-OHPhe 和 9-OHPhe 的 HSA 的猝灭常数比 BSA 的大得多。从 HSA 中的色氨酸 (Trp) 残基到 1-OHPhe 和 9-OHPhe 的能量转移比从 BSA 中的色氨酸转移的可能性更大。HSA和BSA中1-OHPhe和9-OHPhe与Trp的相互作用改变了Trp的微环境。分子对接结果表明1-OHPhe和9-OHPhe与HSA和BSA的结合方式和结合力不同。两种 OH-PAHs 被用作荧光探针来分析 HSA 和 BSA 的微环境疏水性,它们明显不同。HSA 和 BSA 之间的结构差异导致它们与 1-OHPhe 和 9-OHPhe 的结合行为发生显着变化。此外,HSA 比 BSA 更容易受到 1-OHHe 和 9-OHHe 的影响。这项工作表明,在相关研究中应考虑两种血清白蛋白之间的差异。HSA 和 BSA 之间的结构差异导致它们与 1-OHPhe 和 9-OHPhe 的结合行为发生显着变化。此外,HSA 比 BSA 更容易受到 1-OHHe 和 9-OHHe 的影响。这项工作表明,在相关研究中应考虑两种血清白蛋白之间的差异。HSA 和 BSA 之间的结构差异导致它们与 1-OHPhe 和 9-OHPhe 的结合行为发生显着变化。此外,HSA 比 BSA 更容易受到 1-OHHe 和 9-OHHe 的影响。这项工作表明,在相关研究中应考虑两种血清白蛋白之间的差异。
更新日期:2022-09-13
中文翻译:

羟基化多环芳烃与血清白蛋白的相互作用:多光谱和分子对接分析
羟基化多环芳烃 (OH-PAHs) 可以与血清白蛋白结合并影响它们在生物体内的分布和消除。在这里,多光谱分析和分子对接方法用于研究两种 OH-PAHs,1-羟基菲 (1-OHPhe) 和 9-羟基菲 (9-OHPhe) 与两种同源血清白蛋白,人血清白蛋白 (HSA) 的结合机制。 ) 和牛血清白蛋白 (BSA)。具有 1-OHPhe 和 9-OHPhe 的 HSA 的猝灭常数比 BSA 的大得多。从 HSA 中的色氨酸 (Trp) 残基到 1-OHPhe 和 9-OHPhe 的能量转移比从 BSA 中的色氨酸转移的可能性更大。HSA和BSA中1-OHPhe和9-OHPhe与Trp的相互作用改变了Trp的微环境。分子对接结果表明1-OHPhe和9-OHPhe与HSA和BSA的结合方式和结合力不同。两种 OH-PAHs 被用作荧光探针来分析 HSA 和 BSA 的微环境疏水性,它们明显不同。HSA 和 BSA 之间的结构差异导致它们与 1-OHPhe 和 9-OHPhe 的结合行为发生显着变化。此外,HSA 比 BSA 更容易受到 1-OHHe 和 9-OHHe 的影响。这项工作表明,在相关研究中应考虑两种血清白蛋白之间的差异。HSA 和 BSA 之间的结构差异导致它们与 1-OHPhe 和 9-OHPhe 的结合行为发生显着变化。此外,HSA 比 BSA 更容易受到 1-OHHe 和 9-OHHe 的影响。这项工作表明,在相关研究中应考虑两种血清白蛋白之间的差异。HSA 和 BSA 之间的结构差异导致它们与 1-OHPhe 和 9-OHPhe 的结合行为发生显着变化。此外,HSA 比 BSA 更容易受到 1-OHHe 和 9-OHHe 的影响。这项工作表明,在相关研究中应考虑两种血清白蛋白之间的差异。































 京公网安备 11010802027423号
京公网安备 11010802027423号