当前位置:
X-MOL 学术
›
Comput. Struct. Biotechnol. J.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
长期模拟揭示了影响 BAY60-7550 选择性的磷酸二酯酶的关键非保守残基
Computational and Structural Biotechnology Journal ( IF 4.4 ) Pub Date : 2022-09-13 , DOI: 10.1016/j.csbj.2022.09.013 Qing Liu 1 , Menghua Song 2 , Yue Qiu 1 , Elaine Lai-Han Leung 3 , Qiang Huang 2, 4 , Xiaojun Yao 1

"点击查看英文标题和摘要"
更新日期:2022-09-13
Computational and Structural Biotechnology Journal ( IF 4.4 ) Pub Date : 2022-09-13 , DOI: 10.1016/j.csbj.2022.09.013 Qing Liu 1 , Menghua Song 2 , Yue Qiu 1 , Elaine Lai-Han Leung 3 , Qiang Huang 2, 4 , Xiaojun Yao 1
Affiliation
|
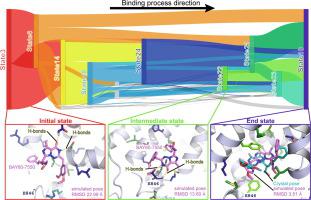
针对特定人类磷酸二酯酶 (PDE) 的选择性抑制剂设计的一个主要障碍是高度保守的催化口袋很难被抑制剂分子区分。为了克服这一点,一条可行的途径是了解当前抑制剂选择性背后的分子决定因素。BAY60-7550(简称BAY;IC 50= 4.7 nM) 是一种针对 PDE2A 的高选择性抑制剂,PDE2A 是一种双特异性 PDE,是中枢神经系统 (CNS) 疾病治疗干预的有吸引力的靶点。最近的研究表明,分子决定因素可能在 BAY 的结合过程中。但是,仍然缺乏对这些过程的详细了解。为了探索这些过程,进行了高通量分子动力学 (HTMD) 模拟,以重现 BAY 与 4 种 PDE 异构体的催化袋的自发结合;进行配体高斯加速分子动力学 (LiGaMD) 模拟以重现 PDE2A 系统中 FKG 和 MC2(两种吡唑并嘧啶酮 PDE2A 选择性抑制剂)的解结合 - 重新结合过程。通过马尔可夫状态模型 (MSM) 和分子力学/广义玻恩表面积 (MM/GBSA) 分析产生的分子轨迹。结果表明,非保守残基与BAY之间的非共价相互作用,尤其是氢键,决定了BAY在PDE2A表面的独特结合途径。这些途径不同于其他三种 PDE 异构体表面的 BAY 途径以及 PDE2A 系统中其他两种 PDE2A 抑制剂的结合途径。这些差异最终反映在这种抑制剂对 PDE2A 的高选择性上。因此,本研究证明了结合过程在 BAY 选择性中的关键作用,并确定了影响 BAY 结合过程的关键非保守残基。因此,

"点击查看英文标题和摘要"


















































 京公网安备 11010802027423号
京公网安备 11010802027423号