当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Complete Biosynthetic Pathway of the Phosphonate Phosphonothrixin: Two Distinct Thiamine Diphosphate-Dependent Enzymes Divide the Work to Form a C–C Bond
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2022-09-06 , DOI: 10.1021/jacs.2c06546 Yuxun Zhu 1 , Taro Shiraishi 1 , Jianwen Lin 1 , Keito Inaba 1 , Atsuro Ito 1 , Yusuke Ogura 1 , Makoto Nishiyama 1 , Tomohisa Kuzuyama 1, 2
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2022-09-06 , DOI: 10.1021/jacs.2c06546 Yuxun Zhu 1 , Taro Shiraishi 1 , Jianwen Lin 1 , Keito Inaba 1 , Atsuro Ito 1 , Yusuke Ogura 1 , Makoto Nishiyama 1 , Tomohisa Kuzuyama 1, 2
Affiliation
|
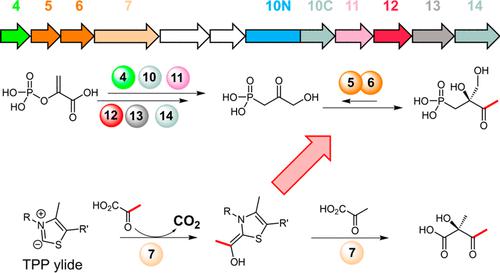
Phosphonates often exhibit biological activities by mimicking the phosphates and carboxylates of biological molecules. The phosphonate phosphonothrixin (PTX), produced by the soil-dwelling bacterium Saccharothrix sp. ST-888, exhibits herbicidal activity. In this study, we propose a complete biosynthetic pathway for PTX by reconstituting its biosynthesis in vitro. Our intensive analysis demonstrated that two dehydrogenases together reduce phosphonopyruvate (PnPy) to 2-hydroxy-3-phosphonopropanoic acid (HPPA) to accelerate the thermodynamically unfavorable rearrangement of phosphoenolpyruvate (PEP) to PnPy. The next four enzymes convert HPPA to (3-hydroxy-2-oxopropyl)phosphonic acid (HOPA). In the final stage of PTX biosynthesis, the “split-gene” transketolase homologue, PtxB5/6, catalyzes the transfer of a two-carbon unit attached to the thiamine diphosphate (TPP) cofactor (provided by the acetohydroxyacid synthase homologue, PtxB7) to HOPA to produce PTX. This study reveals a unique C–C bond formation in which two distinct TPP-dependent enzymes, PtxB5/6 and PtxB7, divide the work to transfer an acetyl group, highlighting an unprecedented biosynthetic strategy for natural products.
中文翻译:

膦酸盐膦丝菌素的完整生物合成途径:两种不同的硫胺素二磷酸依赖性酶分工形成 C-C 键
膦酸盐通常通过模仿生物分子的磷酸盐和羧酸盐来表现出生物活性。由土壤栖息细菌糖丝菌产生的膦酸盐磷酸丝菌素 (PTX)sp。ST-888,具有除草活性。在这项研究中,我们通过在体外重建其生物合成,提出了 PTX 的完整生物合成途径。我们的深入分析表明,两种脱氢酶一起将膦酰基丙酮酸 (PnPy) 还原为 2-羟基-3-膦酰基丙酸 (HPPA),以加速磷酸烯醇丙酮酸 (PEP) 向 PnPy 的热力学不利重排。接下来的四种酶将 HPPA 转化为 (3-羟基-2-氧代丙基) 膦酸 (HOPA)。在 PTX 生物合成的最后阶段,“分裂基因”转酮醇酶同源物 PtxB5/6 催化连接到硫胺素二磷酸 (TPP) 辅因子(由乙酰羟酸合酶同源物 PtxB7 提供)上的两个碳单元转移到HOPA 生产 PTX。这项研究揭示了一种独特的 C-C 键形成,其中两种不同的 TPP 依赖性酶,
更新日期:2022-09-06
中文翻译:

膦酸盐膦丝菌素的完整生物合成途径:两种不同的硫胺素二磷酸依赖性酶分工形成 C-C 键
膦酸盐通常通过模仿生物分子的磷酸盐和羧酸盐来表现出生物活性。由土壤栖息细菌糖丝菌产生的膦酸盐磷酸丝菌素 (PTX)sp。ST-888,具有除草活性。在这项研究中,我们通过在体外重建其生物合成,提出了 PTX 的完整生物合成途径。我们的深入分析表明,两种脱氢酶一起将膦酰基丙酮酸 (PnPy) 还原为 2-羟基-3-膦酰基丙酸 (HPPA),以加速磷酸烯醇丙酮酸 (PEP) 向 PnPy 的热力学不利重排。接下来的四种酶将 HPPA 转化为 (3-羟基-2-氧代丙基) 膦酸 (HOPA)。在 PTX 生物合成的最后阶段,“分裂基因”转酮醇酶同源物 PtxB5/6 催化连接到硫胺素二磷酸 (TPP) 辅因子(由乙酰羟酸合酶同源物 PtxB7 提供)上的两个碳单元转移到HOPA 生产 PTX。这项研究揭示了一种独特的 C-C 键形成,其中两种不同的 TPP 依赖性酶,































 京公网安备 11010802027423号
京公网安备 11010802027423号