当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
革兰氏阳性细菌菌毛中自催化分子内异肽键的形成:QM/MM 模拟
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2011-01-26 , DOI: 10.1021/ja107513t
Xiangqian Hu 1 , Hao Hu , Jeffrey A Melvin , Kathleen W Clancy , Dewey G McCafferty , Weitao Yang
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2011-01-26 , DOI: 10.1021/ja107513t
Xiangqian Hu 1 , Hao Hu , Jeffrey A Melvin , Kathleen W Clancy , Dewey G McCafferty , Weitao Yang
Affiliation
|
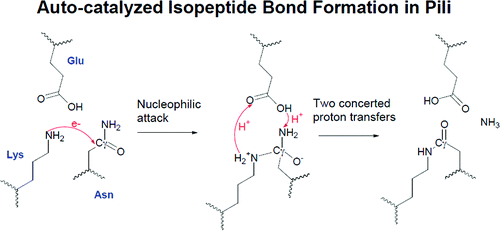
许多革兰氏阳性病原体具有外部菌毛或菌毛,在感染过程中它们通过这些菌毛或菌毛粘附在宿主细胞上。最初在化脓性链球菌菌毛亚基 Spy0128 中观察到菌毛亚基的 N 端和 C 端结构域内的 Asn 和 Lys 侧链之间不寻常的双分子内异肽键,随后在无乳链球菌的 GBS52 中、在 BcpA 主要菌毛蛋白中观察到。蜡样芽孢杆菌和肺炎链球菌的 RrgB 菌毛蛋白等。在每个菌毛蛋白亚基内,分子内异肽键起到稳定蛋白质的作用。这些键提供了一种承受大的外部机械力的方法,并且可能有助于支持通过分选酶转肽酶进行菌毛蛋白亚基聚合的构象。对含有菌毛的革兰氏阳性细菌的全基因组分析已知或怀疑菌毛蛋白亚基中含有异肽键。对于异肽交联的自催化形成,包括 Asn、Lys 在内的三个氨基酸和催化重要的酸性 Glu(或 Asp)残基的保守性负责。然而,菌毛蛋白内异肽键如何形成的化学机制仍然知之甚少。尽管多种机制路径可能导致菌毛中异肽键的形成,但在许多菌毛蛋白晶体结构(例如 Spy0128 和 RrgB)中发现了活性位点疏水环境中保守的谷氨酸和残基高度有序定位的要求。这表明了一种机制,涉及赖氨酸侧链胺与天冬酰胺甲酰胺的直接偶联,该偶联是通过与催化谷氨酸残基的关键酸/碱或氢键相互作用介导的。从这个机理的角度来看,我们使用QM/MM最小自由能路径方法来检查以Spy0128作为模型菌毛蛋白形成异肽键的反应细节,特别关注谷氨酸在催化中的作用。据确定,反应机制可能由两个主要步骤组成:未质子化的赖氨酸ε-氨基中的氮对Cγ进行亲核攻击,然后在分子内异肽键的形成过程中发生两次协同的质子转移,随后释放氨。更重要的是,在 Spy0128 的双活性位点内,Glu(117) 和 Glu(258) 残基通过中继两次质子转移分别充当每个异肽键形成的关键催化剂。这项工作还表明,Spy0128 内的域-域相互作用可能调节每个活性位点内残基的反应性。我们的结果有望揭示革兰氏阳性菌菌毛蛋白生物发生的分子机制。

"点击查看英文标题和摘要"
更新日期:2011-01-26

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号