当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Dependence of Electrochemical and Electrogenerated Chemiluminescence Properties on the Structure of BODIPY Dyes. Unusually Large Separation between Sequential Electron Transfers
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2010-12-15 , DOI: 10.1021/ja108108d Alexander B. Nepomnyashchii 1 , Sangik Cho 1 , Peter J. Rossky 1 , Allen J. Bard 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2010-12-15 , DOI: 10.1021/ja108108d Alexander B. Nepomnyashchii 1 , Sangik Cho 1 , Peter J. Rossky 1 , Allen J. Bard 1
Affiliation
|
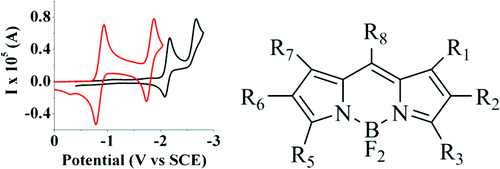
Electrochemistry and electrogenerated chemiluminescence (ECL) of selected substituted BODIPY (4,4-difluoro-4-bora-3a,4a-diaza-s-indacene) dyes have been studied. The location and nature of substituents on positions 1-8 are important in predicting the behavior, and especially the stability, of the radical ions formed on electron transfer. Dyes with unsubstituted positions 2, 6, and 8 show a kinetic contribution to both oxidation and reduction. Dyes with only unsubstituted positions 2 and 6 and a substituted 8 position show chemically reversible reduction but irreversible oxidation. Unsubstituted positions 2 and 6 tend to show dimer formation on oxidation. Completely substituted dyes show nernstian oxidation and reduction. Oxidation and reduction studies of simple BODIPY dyes show an unusually large separation between the first and second reduction peaks and also the first and second oxidation peaks, of about 1.1 V, which is very different from that observed for polycyclic hydrocarbons and other heteroaromatic compounds, where the spacing is usually about 0.5 V. Electronic structure calculations confirmed this behavior, and this effect is attributed to a greater electronic energy required to withdraw or add a second electron and a lower relative solvation energy for the dianion or dication compared with those of the polycyclic hydrocarbons. ECL was generated for all compounds either by annihilation or by using a co-reactant.
中文翻译:

电化学和电生化学发光特性对 BODIPY 染料结构的依赖性。顺序电子转移之间异常大的分离
已经研究了选定的取代 BODIPY(4,4-difluoro-4-bora-3a,4a-diaza-s-indacene)染料的电化学和电致化学发光 (ECL)。1-8 位取代基的位置和性质对于预测电子转移时形成的自由基离子的行为,尤其是稳定性很重要。具有未取代的 2、6 和 8 位的染料显示出对氧化和还原的动力学贡献。仅具有未取代的 2 和 6 位以及取代的 8 位的染料显示化学可逆还原但不可逆氧化。未取代的 2 和 6 位倾向于在氧化时形成二聚体。完全取代的染料显示出能斯特氧化和还原。简单 BODIPY 染料的氧化和还原研究表明,第一个和第二个还原峰以及第一个和第二个氧化峰之间的分离异常大,约为 1.1 V,这与在多环烃和其他杂芳族化合物中观察到的非常不同,其中间距通常约为 0.5 V。电子结构计算证实了这种行为,这种效应归因于与多环相比,撤回或添加第二个电子所需的电子能量更大,而二价阴离子或二价阳离子的相对溶剂化能更低碳氢化合物。通过湮灭或使用共反应物为所有化合物生成 ECL。这与在多环烃和其他杂芳族化合物中观察到的非常不同,其中的间距通常约为 0.5 V。电子结构计算证实了这种行为,这种效应归因于撤回或添加第二个电子所需的更大的电子能量和与多环烃相比,二价阴离子或二价阳离子的相对溶剂化能较低。通过湮灭或使用共反应物为所有化合物生成 ECL。这与在多环烃和其他杂芳族化合物中观察到的非常不同,其中的间距通常约为 0.5 V。电子结构计算证实了这种行为,这种效应归因于撤回或添加第二个电子所需的更大的电子能量和与多环烃相比,二价阴离子或二价阳离子的相对溶剂化能较低。通过湮灭或使用共反应物为所有化合物生成 ECL。这种效应归因于与多环烃相比,撤回或添加第二个电子所需的电子能量更大,而二价阴离子或二价阳离子的相对溶剂化能更低。通过湮灭或使用共反应物为所有化合物生成 ECL。这种效应归因于与多环烃相比,撤回或添加第二个电子所需的电子能量更大,而二价阴离子或二价阳离子的相对溶剂化能更低。通过湮灭或使用共反应物为所有化合物生成 ECL。
更新日期:2010-12-15
中文翻译:

电化学和电生化学发光特性对 BODIPY 染料结构的依赖性。顺序电子转移之间异常大的分离
已经研究了选定的取代 BODIPY(4,4-difluoro-4-bora-3a,4a-diaza-s-indacene)染料的电化学和电致化学发光 (ECL)。1-8 位取代基的位置和性质对于预测电子转移时形成的自由基离子的行为,尤其是稳定性很重要。具有未取代的 2、6 和 8 位的染料显示出对氧化和还原的动力学贡献。仅具有未取代的 2 和 6 位以及取代的 8 位的染料显示化学可逆还原但不可逆氧化。未取代的 2 和 6 位倾向于在氧化时形成二聚体。完全取代的染料显示出能斯特氧化和还原。简单 BODIPY 染料的氧化和还原研究表明,第一个和第二个还原峰以及第一个和第二个氧化峰之间的分离异常大,约为 1.1 V,这与在多环烃和其他杂芳族化合物中观察到的非常不同,其中间距通常约为 0.5 V。电子结构计算证实了这种行为,这种效应归因于与多环相比,撤回或添加第二个电子所需的电子能量更大,而二价阴离子或二价阳离子的相对溶剂化能更低碳氢化合物。通过湮灭或使用共反应物为所有化合物生成 ECL。这与在多环烃和其他杂芳族化合物中观察到的非常不同,其中的间距通常约为 0.5 V。电子结构计算证实了这种行为,这种效应归因于撤回或添加第二个电子所需的更大的电子能量和与多环烃相比,二价阴离子或二价阳离子的相对溶剂化能较低。通过湮灭或使用共反应物为所有化合物生成 ECL。这与在多环烃和其他杂芳族化合物中观察到的非常不同,其中的间距通常约为 0.5 V。电子结构计算证实了这种行为,这种效应归因于撤回或添加第二个电子所需的更大的电子能量和与多环烃相比,二价阴离子或二价阳离子的相对溶剂化能较低。通过湮灭或使用共反应物为所有化合物生成 ECL。这种效应归因于与多环烃相比,撤回或添加第二个电子所需的电子能量更大,而二价阴离子或二价阳离子的相对溶剂化能更低。通过湮灭或使用共反应物为所有化合物生成 ECL。这种效应归因于与多环烃相比,撤回或添加第二个电子所需的电子能量更大,而二价阴离子或二价阳离子的相对溶剂化能更低。通过湮灭或使用共反应物为所有化合物生成 ECL。





















































 京公网安备 11010802027423号
京公网安备 11010802027423号