当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
磷酸吡哆醛依赖性天冬氨酸氨基转移酶的光增强催化
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2010-12-01 , DOI: 10.1021/ja107054x
Melissa P Hill 1 , Elizabeth C Carroll , Mai C Vang , Trevor A Addington , Michael D Toney , Delmar S Larsen
Affiliation
|
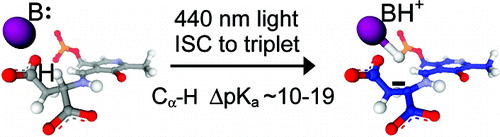
吡哆醛 5'-磷酸 (PLP) 依赖性酶的机制需要底物形成共价“外部醛亚胺”中间体,该中间体强烈吸收 410 至 430 nm 之间的光。天冬氨酸转氨酶 (AAT) 是一种典型的 PLP 依赖性酶,可催化天冬氨酸和 α-酮戊二酸与草乙酸和谷氨酸的可逆相互转化。根据动力学同位素效应研究,已知天冬氨酸外部醛亚胺 C(α)-H 键去质子化生成碳阴离子醌类中间体在热 AAT 反应中部分限制速率。基于溶液中席夫碱的研究,我们发现 430 nm 外部醛亚胺吸收带的激发增加了 AAT 的稳态催化活性,这归因于 C(α)-H 去质子化的光增强。蓝光 (250 mW) 照明观察到 WT AAT 活性增强 2.3 倍,无活性 K258A 突变体增强 530 倍,水中 PLP-Asp 希夫碱增强 58600 倍。这些不同程度的增强与不同环境中 C(α)-H 键的固有反应性相关,反应性较低的席夫碱表现出更大的增强。时间分辨光谱(范围从飞秒到分钟)用于研究水中和与 AAT 结合的 PLP 氨基酸席夫碱中 C(α)-H 键断裂的光活化性质。与热途径不同,光活化途径涉及三重态,其 C(α)-H pK(a) 估计比水中 PLP-Val 希夫碱的基态低 11 至 19 个单位。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号