Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
STK25 通过磷酸化 PKA 信号传导来抑制 PRKAR1A
Cell Reports ( IF 7.5 ) Pub Date : 2022-08-16 , DOI: 10.1016/j.celrep.2022.111203
Xiaokan Zhang 1 , Bryan Z Wang 2 , Michael Kim 1 , Trevor R Nash 2 , Bohao Liu 2 , Jenny Rao 1 , Roberta Lock 3 , Manuel Tamargo 3 , Rajesh Kumar Soni 4 , John Belov 1 , Eric Li 1 , Gordana Vunjak-Novakovic 2 , Barry Fine 1
Affiliation
|
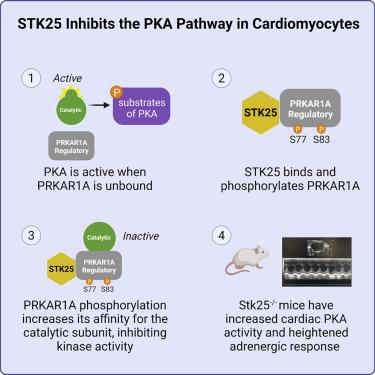
在心脏中,蛋白激酶 A (PKA) 对于激活钙处理和肌节蛋白以响应 β-肾上腺素能刺激至关重要,从而导致心肌收缩力和性能增加。PKA 的催化活性受调节亚基的严格调节,调节亚基抑制催化亚基,直到 cAMP 结合释放。II 型调节亚基的磷酸化促进 PKA 激活;然而,磷酸化在 I 型调节亚基中的作用仍不确定。在这里,我们利用人诱导多能干细胞心肌细胞 (iPSC-CM) 来识别 STK25 作为 Iα 型调节亚基PRKAR1A的激酶。在 cAMP 存在下,PRKAR1A 的磷酸化导致 PKA 激酶活性的抑制并增加与催化亚基的结合。小鼠中的 Stk25 敲除可降低 Prkar1a 磷酸化,增加 Pka 活性,并增强对 β-肾上腺素能刺激的收缩反应。总之,这些数据支持 STK25 通过 PRKAR1A 磷酸化作为 PKA 信号转导的负调节因子。

"点击查看英文标题和摘要"







































 京公网安备 11010802027423号
京公网安备 11010802027423号