当前位置:
X-MOL 学术
›
Bioorgan. Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
环糊精糖基转移酶催化人参皂苷转糖基化受体选择的分子机制
Bioorganic Chemistry ( IF 4.5 ) Pub Date : 2022-08-12 , DOI: 10.1016/j.bioorg.2022.106094
Ying Xiao 1 , Guoning Zhang 1 , Yingbo Yang 2 , Jingxian Feng 1 , Shi Qiu 1 , Zhuzhen Han 1 , Jiaran Geng 1 , Wansheng Chen 3

"点击查看英文标题和摘要"
更新日期:2022-08-17
Bioorganic Chemistry ( IF 4.5 ) Pub Date : 2022-08-12 , DOI: 10.1016/j.bioorg.2022.106094
Ying Xiao 1 , Guoning Zhang 1 , Yingbo Yang 2 , Jingxian Feng 1 , Shi Qiu 1 , Zhuzhen Han 1 , Jiaran Geng 1 , Wansheng Chen 3
Affiliation
|
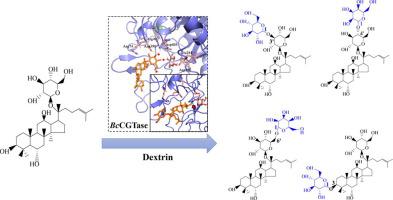
从基本观点和实际应用来看,了解酶特异性的机制越来越重要。由于其在体内和体外改善受体底物功能特性的重要性,转糖基化引起了许多关注。环糊精葡聚糖转移酶(CGTase)是转糖基化的关键酶之一,底物谱广,以糖为供体。然而,人们对 CGTase 的受体选择性知之甚少,这极大地阻碍了合理设计所需转糖基化衍生物的努力。在这项研究中,我们发现来自环状芽孢杆菌的 CGT 酶,BcCGTase 能够与多种人参皂苷形成糖基化产物。特别是,它不仅可以通过将葡萄糖部分转移到 CO Glc 位置进行各种单、二甚至更高级的糖基化 ,
, 而且可以糖基化人参皂苷的 C3-OH 位置。相比之下,来自地衣芽孢杆菌的另一种 CGT 酶( Bl CGTase) 显示出相对特异性的受体偏好,只有几种人参皂苷。Bc CGTase 和Bl CGTase之间的结构比较表明 Arg74/K81 位置在Bc CGTase/ Bl的受体结合位点内CGTase 是造成人参皂甙 F1 催化特异性差异的原因。进一步的诱变证实了它们在受体选择中的作用。总之,我们的研究不仅证明了 CGTase 的受体选择性,而且还提供了对 CGTase 催化机制的深入了解,这将潜在地增加 CGTase 在生物合成新的、合理设计的转糖基化衍生物中的效用。
而且可以糖基化人参皂苷的 C3-OH 位置。相比之下,来自地衣芽孢杆菌的另一种 CGT 酶( Bl CGTase) 显示出相对特异性的受体偏好,只有几种人参皂苷。Bc CGTase 和Bl CGTase之间的结构比较表明 Arg74/K81 位置在Bc CGTase/ Bl的受体结合位点内CGTase 是造成人参皂甙 F1 催化特异性差异的原因。进一步的诱变证实了它们在受体选择中的作用。总之,我们的研究不仅证明了 CGTase 的受体选择性,而且还提供了对 CGTase 催化机制的深入了解,这将潜在地增加 CGTase 在生物合成新的、合理设计的转糖基化衍生物中的效用。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号