当前位置:
X-MOL 学术
›
ACS Appl. Mater. Interfaces
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Protein Cages Engineered for Interaction-Driven Selective Encapsulation of Biomolecules
ACS Applied Materials & Interfaces ( IF 8.3 ) Pub Date : 2022-08-02 , DOI: 10.1021/acsami.2c06924 Yeolin Lee 1 , Minjae Kim 1 , Jin Young Kang 1 , Yongwon Jung 1
ACS Applied Materials & Interfaces ( IF 8.3 ) Pub Date : 2022-08-02 , DOI: 10.1021/acsami.2c06924 Yeolin Lee 1 , Minjae Kim 1 , Jin Young Kang 1 , Yongwon Jung 1
Affiliation
|
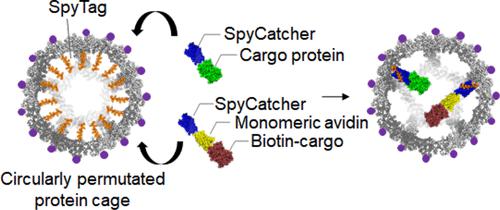
Hollow protein cages have become attractive drug delivery vehicles with high biocompatibility and precise functional/structural manipulability. However, difficulties in effective cargo loading inside the cages have been limiting further development of protein cage-based drug carriers. Here, we developed a specific interaction-driven encapsulation and cellular delivery strategy for various biomolecules by engineering a porous protein cage. The computationally designed hyperstable mi3 protein cage was circularly permuted to fuse the cancer targeting RGD tripeptide to the cage surface and SpyTag (ST), which forms a covalent bond with SpyCatcher (SC), to the cage inner cavity. SC-fused proteins with different sizes and charges could be stably and actively encapsulated in the engineered nanocage via the ST/SC reaction. Cargo protein encapsulation inside the cage was directly confirmed by cryo-electron microscopy (EM) structure determination. In addition, SC-fused monomeric avidin was added to the nanocage to encapsulate various biotinylated (nonprotein) cargos such as oligonucleotides and the anticancer drug doxorubicin. All cargo molecules loaded onto the engineered mi3 were effectively delivered to cells. This work introduces a highly versatile cargo loading/delivery strategy, where loading/delivery interactions, cargo molecules, and cell targeting moieties can be further varied for optimal cellular drug delivery.
中文翻译:

为相互作用驱动的生物分子选择性封装而设计的蛋白质笼
中空蛋白笼已成为具有高生物相容性和精确的功能/结构可操作性的有吸引力的药物递送载体。然而,笼内有效装载货物的困难限制了基于蛋白质笼的药物载体的进一步发展。在这里,我们通过设计多孔蛋白质笼,为各种生物分子开发了一种特定的相互作用驱动的封装和细胞递送策略。计算设计的超稳定 mi3 蛋白笼被循环置换,以将靶向 RGD 三肽的癌症融合到笼表面,并将与 SpyCatcher (SC) 形成共价键的 SpyTag (ST) 融合到笼内腔。通过 ST/SC 反应,具有不同大小和电荷的 SC 融合蛋白可以稳定且主动地封装在工程纳米笼中。通过低温电子显微镜 (EM) 结构测定直接证实了笼内的货物蛋白封装。此外,将 SC 融合的单体抗生物素蛋白添加到纳米笼中以封装各种生物素化(非蛋白质)货物,例如寡核苷酸和抗癌药物阿霉素。装载到工程 mi3 上的所有货物分子都被有效地输送到细胞中。这项工作引入了一种高度通用的货物装载/递送策略,其中装载/递送相互作用、货物分子和细胞靶向部分可以进一步变化,以实现最佳的细胞药物递送。将 SC 融合的单体抗生物素蛋白添加到纳米笼中以封装各种生物素化(非蛋白质)货物,例如寡核苷酸和抗癌药物阿霉素。装载到工程 mi3 上的所有货物分子都被有效地输送到细胞中。这项工作引入了一种高度通用的货物装载/递送策略,其中装载/递送相互作用、货物分子和细胞靶向部分可以进一步变化,以实现最佳的细胞药物递送。将 SC 融合的单体抗生物素蛋白添加到纳米笼中以封装各种生物素化(非蛋白质)货物,例如寡核苷酸和抗癌药物阿霉素。装载到工程 mi3 上的所有货物分子都被有效地输送到细胞中。这项工作引入了一种高度通用的货物装载/递送策略,其中装载/递送相互作用、货物分子和细胞靶向部分可以进一步变化,以实现最佳的细胞药物递送。
更新日期:2022-08-02
中文翻译:

为相互作用驱动的生物分子选择性封装而设计的蛋白质笼
中空蛋白笼已成为具有高生物相容性和精确的功能/结构可操作性的有吸引力的药物递送载体。然而,笼内有效装载货物的困难限制了基于蛋白质笼的药物载体的进一步发展。在这里,我们通过设计多孔蛋白质笼,为各种生物分子开发了一种特定的相互作用驱动的封装和细胞递送策略。计算设计的超稳定 mi3 蛋白笼被循环置换,以将靶向 RGD 三肽的癌症融合到笼表面,并将与 SpyCatcher (SC) 形成共价键的 SpyTag (ST) 融合到笼内腔。通过 ST/SC 反应,具有不同大小和电荷的 SC 融合蛋白可以稳定且主动地封装在工程纳米笼中。通过低温电子显微镜 (EM) 结构测定直接证实了笼内的货物蛋白封装。此外,将 SC 融合的单体抗生物素蛋白添加到纳米笼中以封装各种生物素化(非蛋白质)货物,例如寡核苷酸和抗癌药物阿霉素。装载到工程 mi3 上的所有货物分子都被有效地输送到细胞中。这项工作引入了一种高度通用的货物装载/递送策略,其中装载/递送相互作用、货物分子和细胞靶向部分可以进一步变化,以实现最佳的细胞药物递送。将 SC 融合的单体抗生物素蛋白添加到纳米笼中以封装各种生物素化(非蛋白质)货物,例如寡核苷酸和抗癌药物阿霉素。装载到工程 mi3 上的所有货物分子都被有效地输送到细胞中。这项工作引入了一种高度通用的货物装载/递送策略,其中装载/递送相互作用、货物分子和细胞靶向部分可以进一步变化,以实现最佳的细胞药物递送。将 SC 融合的单体抗生物素蛋白添加到纳米笼中以封装各种生物素化(非蛋白质)货物,例如寡核苷酸和抗癌药物阿霉素。装载到工程 mi3 上的所有货物分子都被有效地输送到细胞中。这项工作引入了一种高度通用的货物装载/递送策略,其中装载/递送相互作用、货物分子和细胞靶向部分可以进一步变化,以实现最佳的细胞药物递送。





















































 京公网安备 11010802027423号
京公网安备 11010802027423号