当前位置:
X-MOL 学术
›
Anal. Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
酶动力学和检测器灵敏度决定无扩增 CRISPR-Cas12 和 CRISPR-Cas13 诊断的检测限
Analytical Chemistry ( IF 6.7 ) Pub Date : 2022-06-27 , DOI: 10.1021/acs.analchem.2c01670 Diego A Huyke 1 , Ashwin Ramachandran 2 , Vladimir I Bashkirov 3 , Efthalia K Kotseroglou 3 , Theofilos Kotseroglou 3 , Juan G Santiago 1
Affiliation
|
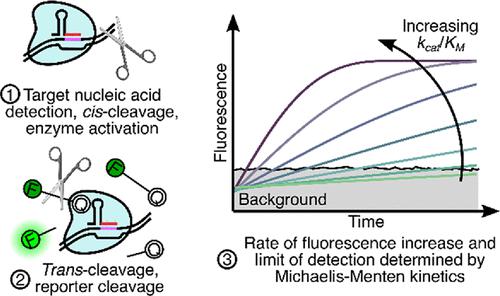
人们对 CRISPR-Cas12 和 CRISPR-Cas13 检测的兴趣不断增加,因为这些检测方案能够特异性识别核酸。这些方案的基本灵敏度限制(及其在无扩增测定中的适用性)由动力学速率控制。然而,人们对这些动力学速率仍然知之甚少,而且它们的报告也不一致。我们量化了几种酶(LbCas12a、AsCas12a、AapCas12b、LwaCas13a 和 LbuCas13a)的动力学参数及其相应的检测限 (LoD)。总的来说,我们对 14 种向导 RNA (gRNA) 和核酸靶标的酶动力学进行了量化,总共 50 组动力学速率参数和 25 个 LoD。我们通过将趋势和限制行为与 Michaelis-Menten反式裂解反应动力学模型进行比较,验证了我们测量的自我一致性。对于我们的测定条件,活化的 Cas12 和 Cas13 酶表现出 10 5和 10 6 M –1 s –1级之间的反式裂解催化效率。对于使用荧光报告分子(ssDNA 和 ssRNA)进行靶标检测的测定,当前测定条件下的动力学速率会导致皮摩尔范围内的无扩增 LoD。结果表明,成功检测目标需要至少 0.1% 的荧光报告分子裂解(通过激活的 CRISPR 酶)。需要这部分被切割的报告基因来区分信号与背景,并且我们假设所需的部分在很大程度上独立于检测方法(例如,终点与反应速度)和检测器灵敏度。 我们的结果证明了动力学速率和背景信号限制 LoD 的基本性质,从而突出了 CRISPR 诊断这一新兴领域的改进领域。

"点击查看英文标题和摘要"


















































 京公网安备 11010802027423号
京公网安备 11010802027423号