当前位置:
X-MOL 学术
›
Chem. Sci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
酰基肽水解酶的冷冻电镜结构揭示了多聚化和多态丝氨酸蛋白酶三联体的底物选择
Chemical Science ( IF 7.6 ) Pub Date : 2022-05-18 , DOI: 10.1039/d2sc02276a Anna J Kiss-Szemán 1 , Pál Stráner 2 , Imre Jákli 1, 2 , Naoki Hosogi 3 , Veronika Harmat 1, 2 , Dóra K Menyhárd 1, 2 , András Perczel 1, 2
Chemical Science ( IF 7.6 ) Pub Date : 2022-05-18 , DOI: 10.1039/d2sc02276a Anna J Kiss-Szemán 1 , Pál Stráner 2 , Imre Jákli 1, 2 , Naoki Hosogi 3 , Veronika Harmat 1, 2 , Dóra K Menyhárd 1, 2 , András Perczel 1, 2
Affiliation
|
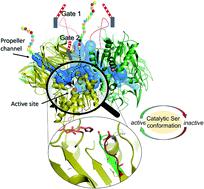
四聚体哺乳动物酰氨基酰基肽酶的第一个结构,一种通过去除末端N作为蛋白酶体上游调节剂的酶来自其蛋白质底物的-乙酰化残基通过低温-EM确定,并通过MD模拟进一步阐明。自关联导致环形四元结构,由淀粉样β-边缘和独特的插入物引导。将 Pro 引入其中央 β 折叠片后,含有催化 Ser587 的片段获得了足够的构象自由度,丝氨酸蛋白酶催化三联体在活性和潜伏状态之间交替。活性位点灵活性表明催化和底物选择的双重功能是通过一种新机制实现的:底物入口由柔性环调节,形成双门通道系统,而底物与活性位点的结合是稳定催化装置——作为水解前的第二个过滤器。

"点击查看英文标题和摘要"
更新日期:2022-05-18

"点击查看英文标题和摘要"




















































 京公网安备 11010802027423号
京公网安备 11010802027423号