Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
PepT1 的胞外域与 TM1 相互作用以促进底物运输
Structure ( IF 4.4 ) Pub Date : 2022-05-16 , DOI: 10.1016/j.str.2022.04.011
Jiemin Shen 1 , Miaohui Hu 2 , Xiao Fan 2 , Zhenning Ren 1 , Corinne Portioli 1 , Xiuwen Yan 1 , Mingqiang Rong 1 , Ming Zhou 1

"点击查看英文标题和摘要"
更新日期:2022-05-16
Structure ( IF 4.4 ) Pub Date : 2022-05-16 , DOI: 10.1016/j.str.2022.04.011
Jiemin Shen 1 , Miaohui Hu 2 , Xiao Fan 2 , Zhenning Ren 1 , Corinne Portioli 1 , Xiuwen Yan 1 , Mingqiang Rong 1 , Ming Zhou 1
Affiliation
|
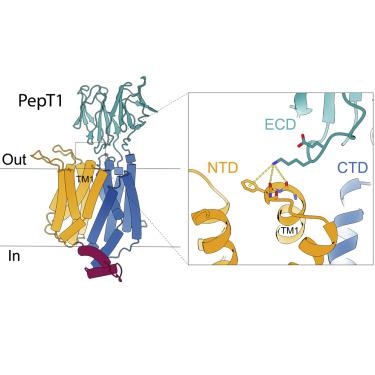
哺乳动物肽转运蛋白 PepT1 和 PepT2 介导小肽的摄取,对于小肽的吸收至关重要。PepT 还介导许多药物和前药的吸收,以提高其生物利用度。PepT 具有 12 个跨膜 (TM) 螺旋,可折叠成 N 端结构域(NTD、TM1-6)和 C 端结构域(CTD、TM7-12),并在 TM9-10 之间具有较大的胞外结构域 (ECD)。众所周知,肽转运需要 NTD 和 CTD 的运动,但 ECD 在 PepT1 中的作用仍不清楚。在这里,我们报道了马 PepT1 的结构,该结构被脂质纳米盘包围并以向内开放的 apo 构象捕获。该结构表明 ECD 通过与 TM1 相互作用来桥接 NTD 和 CTD。ECD 的缺失或 ECD-TM1 接口的突变会损害转运活性。这些结果证明了 ECD 在 PepT1 中的重要作用,并增强了我们对 PepT1 转运机制的理解。

"点击查看英文标题和摘要"







































 京公网安备 11010802027423号
京公网安备 11010802027423号