当前位置:
X-MOL 学术
›
J. Colloid Interface Sci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
脂质膜中组织因子 (TF) 和 TF 因子 VIIa 复合物的结构模型:实验和计算相结合的研究
Journal of Colloid and Interface Science ( IF 9.4 ) Pub Date : 2022-05-11 , DOI: 10.1016/j.jcis.2022.04.147 Alessandra Luchini 1 , Frederik Grønbæk Tidemand 1 , Raul Araya-Secchi 1 , Mario Campana 2 , Marité Cárdenas 3 , Lise Arleth 1

"点击查看英文标题和摘要"
更新日期:2022-05-11
Journal of Colloid and Interface Science ( IF 9.4 ) Pub Date : 2022-05-11 , DOI: 10.1016/j.jcis.2022.04.147 Alessandra Luchini 1 , Frederik Grønbæk Tidemand 1 , Raul Araya-Secchi 1 , Mario Campana 2 , Marité Cárdenas 3 , Lise Arleth 1
Affiliation
|
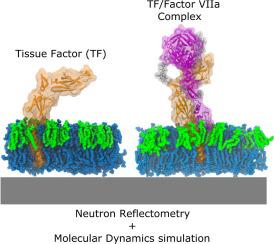
组织因子(TF)是一种参与血液凝固的膜蛋白。TF 引发一系列蛋白水解反应,最终导致血凝块的形成。第一个反应包括凝血因子 VII 的结合及其向活化形式 FVIIa 的转化。在这里,我们将实验(即石英晶体微天平与耗散监测和中子反射计)和计算(即分子动力学 (MD) 模拟)方法相结合,以推导出脂质双层中 TF 和 TF/FVIIa 复合物的完整结构模型。该模型显示 TF 跨膜结构域 (TMD) 和将 TMD 连接到细胞外结构域 (ECD) 的柔性接头定义了 ECD 在膜表面上的位置。ECD 相对于双层表面的平均取向略微向脂质头基倾斜,我们认为这种构象由磷脂酰丝氨酸脂质促进,并有利于 FVIIa 的结合。另一方面,TF/FVIIa 复合物的形成会引起 TF 结构的微小变化,并降低 TF 和 FVIIA 的构象自由度。总之,我们描述了有利于凝血的蛋白质-蛋白质和蛋白质-脂质相互作用,但也有助于新药的开发。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号