当前位置:
X-MOL 学术
›
Comput. Biol. Med.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
探索血红素过氧化物酶的结构功能关系:细胞色素c过氧化物酶变体的分子动力学研究
Computers in Biology and Medicine ( IF 7.0 ) Pub Date : 2022-04-28 , DOI: 10.1016/j.compbiomed.2022.105544
Mohamed M Aboelnga 1

"点击查看英文标题和摘要"
更新日期:2022-04-30
Computers in Biology and Medicine ( IF 7.0 ) Pub Date : 2022-04-28 , DOI: 10.1016/j.compbiomed.2022.105544
Mohamed M Aboelnga 1
Affiliation
|
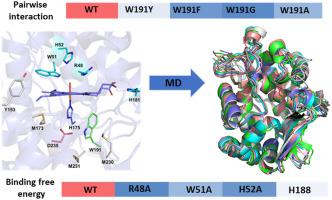
细胞色素c过氧化物酶 (Ccp1) 是一种线粒体含血红素酶,几十年来一直作为化学模型探索血红素酶的结构功能关系。揭示其血红素口袋残基对结构行为、非共价相互作用及其过氧化物酶活性的影响已成为越来越受关注的问题。为了进一步探索这些作用,我们对 WT 和 19 个计算机生成的 Ccp1 变体进行了密集的全原子分子动力学模拟,然后对 H 2 O 2进行了详细的结构和能量分析结合和成对相互作用。包括 RMSD、RMSF、回转半径和氢键数量在内的不同结构分析清楚地表明,所研究的突变体均未诱导相对于 WT 行为的显着结构变化。与实验观察结果非常一致,发现所有研究的突变系统引起的结构变化仅局限于其周围环境。确定的 WT Ccp1 和 19 种变体的残基和 Gibbs 结合能之间的相互作用能有助于确定每个突变残基对 H 2 O 2结合的精确影响和非共价相互作用以及因此的整体过氧化物酶活性。周围残基在 Ccp1 采用独特的独特电子特征中的作用已被识别。我们有价值的发现阐明了 Ccp1 中各种残基的功能,从而为其功能提供了新的原子论见解。总体而言,由于各种过氧化物酶中血红素口袋的保守残基,这项工作中获得的评论非常有价值。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号