当前位置:
X-MOL 学术
›
J. Chem. Inf. Model.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
磷脂酶 C 的标准结合自由能和膜解吸机制
Journal of Chemical Information and Modeling ( IF 5.6 ) Pub Date : 2022-03-28 , DOI: 10.1021/acs.jcim.1c01543 Emmanuel E Moutoussamy 1, 2 , Hanif M Khan 1, 2 , Mary F Roberts 3 , Anne Gershenson 4 , Christophe Chipot 5, 6 , Nathalie Reuter 2, 7
Journal of Chemical Information and Modeling ( IF 5.6 ) Pub Date : 2022-03-28 , DOI: 10.1021/acs.jcim.1c01543 Emmanuel E Moutoussamy 1, 2 , Hanif M Khan 1, 2 , Mary F Roberts 3 , Anne Gershenson 4 , Christophe Chipot 5, 6 , Nathalie Reuter 2, 7
Affiliation
|
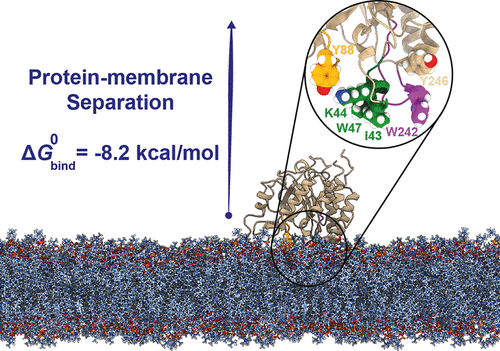
外周膜蛋白 (PMP) 暂时结合到细胞膜上,并在信号转导、脂质代谢和膜运输中发挥重要作用。使用实验技术获得准确的膜-PMP 亲和力比在水溶液中获得蛋白质-配体亲和力更具挑战性。在理论层面上,由于生物体的大小、缓慢的脂质扩散以及伴随结合的构型熵的巨大变化,使用分子动力学模拟计算标准蛋白质-膜结合自由能仍然是一项艰巨的挑战过程。为了克服这些挑战,我们使用了一个计算框架,该框架依赖于一系列平均力势 (PMF) 计算,包括一组对集体变量的几何约束。选择苏云金芽孢杆菌磷脂酰肌醇特异性磷脂酶 C ( Bt PI-PLC) 是因为其作为毒力因子的重要性以及大量可用的实验亲和数据。我们计算出的标准结合自由能为 -8.2 ± 1.4 kcal/mol,与报告的实验值(-6.6 ± 0.2 kcal/mol)合理一致。根据 2.3 μs 分离 PMF 计算,我们研究了Bt PI-PLC 在分离过程中脱离与脂质双层相互作用的机制。我们描述了一个短的两亲性螺旋如何参与短暂的相互作用,以缓解其疏水物在从双层解吸时通过界面区域的通道。

"点击查看英文标题和摘要"
更新日期:2022-03-28

"点击查看英文标题和摘要"


















































 京公网安备 11010802027423号
京公网安备 11010802027423号