当前位置:
X-MOL 学术
›
J. Mol. Graph. Model.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
颗粒酶 B 在底物和抑制剂结合上的催化机制的结构见解
Journal of Molecular Graphics and Modelling ( IF 2.7 ) Pub Date : 2022-03-22 , DOI: 10.1016/j.jmgm.2022.108167 Neha Tripathi 1 , Richard Danger 2 , Mélanie Chesneau 2 , Sophie Brouard 3 , Adèle D Laurent 1

"点击查看英文标题和摘要"
更新日期:2022-03-22
Journal of Molecular Graphics and Modelling ( IF 2.7 ) Pub Date : 2022-03-22 , DOI: 10.1016/j.jmgm.2022.108167 Neha Tripathi 1 , Richard Danger 2 , Mélanie Chesneau 2 , Sophie Brouard 3 , Adèle D Laurent 1
Affiliation
|
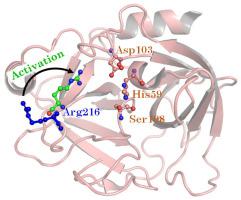
人类颗粒酶B(hGzmB)存在于各种免疫细胞中,由于其在各种病理生理状况中的作用而备受关注。hGzmB 活性在催化三联体(His59、Asp103、Ser198)处触发,切割其特定底物。迄今为止,针对hGzmB的药物设计策略主要针对催化三联体,由于丝氨酸蛋白酶中高度保守的活性位点,导致抑制剂的非特异性问题。在目前的工作中,微秒经典分子动力学模拟致力于探索在已知底物 Ac-IEPD-AMC(活性 hGzmB)和已知抑制剂 Ac-IEPD-CHO 存在下 hGzmB 催化循环的结构动力学(非活动 hGzmB)。通过比较 hGzmB 催化循环的六个不同阶段中 hGzmB 的活性和非活性形式,我们发现,这是第一次,涉及 Arg216 的额外相互作用网络,Arg216 是位于常规结合位点之外的残基。激活后,His59∙∙∙Asp103 氢键由于 Asp103∙∙∙Arg216 盐桥的形成而断裂,从而扩大了活性位点以促进底物结合。相反,抑制剂 Ac-IEPD-CHO 与 hGzmB 的结合阻止了 Arg216 介导的催化三联体相互作用,从而阻止了 hGzmB 的活性。计算机Arg216Ala 突变证实了 Arg216 在酶活性中的作用,因为底物 Ac-IEPD-AMC 未能与突变的 hGzmB 结合。重要的是,由于 Arg216 在各种颗粒酶中并不保守,因此目前的发现可能是指导 hGzmB 特异性疗法设计的重要一步。

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号