当前位置:
X-MOL 学术
›
Bioorgan. Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
嗜热链球菌乙酰乳酸脱羧酶的表征及其在α-羟基-β-酮酸脱羧中的立体选择性
Bioorganic Chemistry ( IF 4.5 ) Pub Date : 2022-03-05 , DOI: 10.1016/j.bioorg.2022.105719
Zi-Qi Zheng 1 , Cai-Yun Luo 1 , Han Chen 1 , Huan Sun 1 , Xian Hui 2 , Zi-Dong Chen 1 , Wen-Yun Gao 1 , Heng Li 1

"点击查看英文标题和摘要"
更新日期:2022-03-05
Bioorganic Chemistry ( IF 4.5 ) Pub Date : 2022-03-05 , DOI: 10.1016/j.bioorg.2022.105719
Zi-Qi Zheng 1 , Cai-Yun Luo 1 , Han Chen 1 , Huan Sun 1 , Xian Hui 2 , Zi-Dong Chen 1 , Wen-Yun Gao 1 , Heng Li 1
Affiliation
|
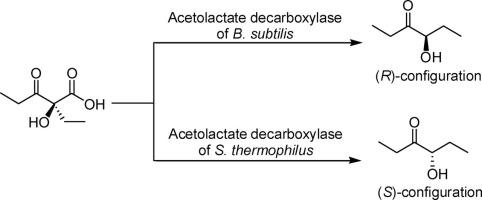
乙酰乳酸脱羧酶 (ALDC) 是一种充分表征的分解代谢酶,可催化 (±)-乙酰乳酸脱羧生成单一产物 ( R )-乙偶姻。它还可以将其他外消旋的α-羟基-β-酮酸转化为相应的R-构型的α-羟基酮。在这项工作中,我们制备了嗜热链球菌(StALDC) 的 ALDC,并探索了它在不同底物上的立体选择性。该酶对底物 (±)-乙酰乳酸不显示对映选择性,但对产物乙偶姻显示R-选择性,这与各种 ALDC 报告的数据相同。然而,当化合物 (±) - 2-propionyl-2-hydroxybutyrate 用作底物时,酶表现出S-对底物和产物均具有选择性,即只能将( S ) -2-丙酰基-2-羟基丁酸脱羧生成( S ) -4-羟基-3-己酮,而不是其R-异构体,这完全不同于为枯草芽孢杆菌ALDC 公布的数据。据我们所知,这是首次报道ALDC的底物依赖性对映选择性,并在同源性建模和分子对接实验的基础上讨论了StALDC的特征。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号