当前位置:
X-MOL 学术
›
BBA Proteins Proteom.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
对源自胶原蛋白 NC1 α1、α2 和 α3 (IV) 结构域的短肽的新见解:一项实验和 MD 模拟研究
Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics ( IF 2.5 ) Pub Date : 2022-02-11 , DOI: 10.1016/j.bbapap.2022.140769
Reyhane Chamani 1 , Mohammad Hossein Taleqani 1 , Aylar Imanpour 2 , Mehri Khatami 1

"点击查看英文标题和摘要"
更新日期:2022-02-11
Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics ( IF 2.5 ) Pub Date : 2022-02-11 , DOI: 10.1016/j.bbapap.2022.140769
Reyhane Chamani 1 , Mohammad Hossein Taleqani 1 , Aylar Imanpour 2 , Mehri Khatami 1
Affiliation
|
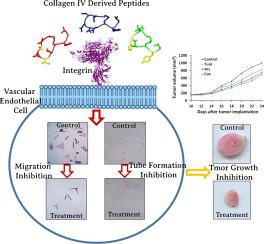
胶原蛋白 NC1 α1 到 α3 (IV) 结构域的蛋白水解切割导致分别称为 Arresten、Canstatin 和 Tumstatin 的抗血管生成蛋白。研究发现,源自塔姆他汀的两种重叠肽比其他片段更有效,氨基酸 L78、V82 和 D84 对其活性至关重要。在本研究中,将含有氨基酸 L78、V82 和 D84 的 Tumstatin (Tum) 衍生的九个氨基酸肽与 Arresten (Ars) 和 Canstatin (Can) 中的相应序列在体外和体内的功效进行了比较. 此外,进行 CD 光谱、MD 和对接模拟以分别评估肽与整合素 αvβ3 的结构和相互作用。结果表明,肽在体外抑制活力、迁移和管形成,以及在体内抑制肿瘤的生长并且 Canstatin 衍生肽比其他肽更有效。CD测量和DSSP计算表明Can具有更多的线圈构象。根据 MD 模拟,与 Tum 和 Ars 相比,Can 具有更多的波动、更少的分子内相互作用和更少的结构紧凑性。可以假设,与其他肽相比,氨基酸变异导致结构更加灵活和松散。Canstatin 衍生肽通过最负的结合能和更多的相互作用与非常接近 RGD 结合位点的整联蛋白 αvβ3 相互作用。总之,我们首次鉴定了一种源自 Canstatin 的活性肽,并表明该序列影响结构,从而影响肽与其受体的相互作用。

"点击查看英文标题和摘要"







































 京公网安备 11010802027423号
京公网安备 11010802027423号