当前位置:
X-MOL 学术
›
Adv. Mater.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Inhaled mRNA Nanoformulation with Biogenic Ribosomal Protein Reverses Established Pulmonary Fibrosis in a Bleomycin-Induced Murine Model
Advanced Materials ( IF 27.4 ) Pub Date : 2022-02-11 , DOI: 10.1002/adma.202107506 Rui Zhang 1 , Weiqiang Jing 2 , Chen Chen 1 , Shengchang Zhang 1 , Mohnad Abdalla 1 , Peng Sun 3 , Ganyu Wang 2 , Wenjie You 4 , Zhenmei Yang 1 , Jing Zhang 1 , Chunwei Tang 1 , Wei Du 1 , Ying Liu 1 , Xiaoxun Li 1 , Jitian Liu 1 , Xiaona You 1 , Huili Hu 5 , Lei Cai 6 , Fengbo Xu 7 , Baixiang Dong 7 , Minglu Liu 8 , Bangming Qiang 8 , Yanhua Sun 9 , Gongchang Yu 10 , Jibiao Wu 3 , Kun Zhao 1 , Xinyi Jiang 1
Advanced Materials ( IF 27.4 ) Pub Date : 2022-02-11 , DOI: 10.1002/adma.202107506 Rui Zhang 1 , Weiqiang Jing 2 , Chen Chen 1 , Shengchang Zhang 1 , Mohnad Abdalla 1 , Peng Sun 3 , Ganyu Wang 2 , Wenjie You 4 , Zhenmei Yang 1 , Jing Zhang 1 , Chunwei Tang 1 , Wei Du 1 , Ying Liu 1 , Xiaoxun Li 1 , Jitian Liu 1 , Xiaona You 1 , Huili Hu 5 , Lei Cai 6 , Fengbo Xu 7 , Baixiang Dong 7 , Minglu Liu 8 , Bangming Qiang 8 , Yanhua Sun 9 , Gongchang Yu 10 , Jibiao Wu 3 , Kun Zhao 1 , Xinyi Jiang 1
Affiliation
|
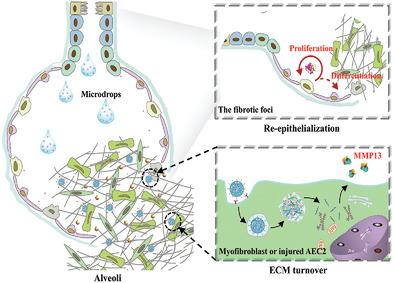
Idiopathic pulmonary fibrosis (IPF), a lethal respiratory disease with few treatment options, occurs due to repetitive microinjuries to alveolar epithelial cells (AECs) and progresses with an overwhelming deposition of extracellular matrix (ECM), ultimately resulting in fibrotic scars and destroyed the alveolar architecture. Here, an inhaled ribosomal protein-based mRNA nanoformulation is reported for clearing the intrapulmonary ECM and re-epithelializing the disrupted alveolar epithelium, thereby reversing established fibrotic foci in IPF. The nanoformulation is sequentially assembled by a ribosomal protein-condensed mRNA core, a bifunctional peptide-modified corona and keratinocyte growth factor (KGF) with a PEGylated shielding shell. When inhaled via a nebulizer, the nanoformulations carried by microdrops are deposited in the alveoli, and penetrate into fibrotic foci, where the outer KGFs are detached after matrix metalloproteinase 2 (MMP2) triggering. The RGD motif-grafted cores then expose and specifically target the integrin-elevated cells for the intracellular delivery of mRNA. Notably, repeated inhalation of the nanoformulations accelerates the clearance of locoregional collagen by boosting the intralesional expression of MMP13 and alveolar re-epithelialization mediated by KGFs, which synergistically ameliorates the lung function of a bleomycin-induced murine model. Therefore, this work provides an alternative mRNA-inhalation delivery strategy, which shows great potential for the treatment of IPF.
中文翻译:

具有生物核糖体蛋白的吸入 mRNA 纳米制剂可逆转博来霉素诱导的小鼠模型中已建立的肺纤维化
特发性肺纤维化 (IPF) 是一种几乎没有治疗选择的致命呼吸系统疾病,由于肺泡上皮细胞 (AEC) 的反复微损伤而发生,并随着细胞外基质 (ECM) 的大量沉积而进展,最终导致纤维化疤痕并破坏肺泡建筑学。在这里,据报道,一种吸入的基于核糖体蛋白的 mRNA 纳米制剂可清除肺内 ECM 并使破坏的肺泡上皮重新上皮化,从而逆转 IPF 中已建立的纤维化病灶。该纳米制剂由核糖体蛋白浓缩的 mRNA 核心、双功能肽修饰的冠状病毒和具有聚乙二醇化屏蔽壳的角质形成细胞生长因子 (KGF) 依次组装而成。当通过雾化器吸入时,微滴携带的纳米制剂会沉积在肺泡中,并渗透到纤维化病灶中,在基质金属蛋白酶 2 (MMP2) 触发后,外部 KGF 分离。然后,移植 RGD 基序的核心暴露并特异性靶向整合素升高的细胞,以进行 mRNA 的细胞内递送。值得注意的是,反复吸入纳米制剂通过促进病灶内 MMP13 的表达和 KGFs 介导的肺泡上皮再形成,加速了局部胶原蛋白的清除,这协同改善了博莱霉素诱导的小鼠模型的肺功能。因此,这项工作提供了一种替代的 mRNA 吸入递送策略,显示出治疗 IPF 的巨大潜力。然后,移植 RGD 基序的核心暴露并特异性靶向整合素升高的细胞,以进行 mRNA 的细胞内递送。值得注意的是,反复吸入纳米制剂通过促进病灶内 MMP13 的表达和 KGFs 介导的肺泡上皮再形成,加速了局部胶原蛋白的清除,这协同改善了博莱霉素诱导的小鼠模型的肺功能。因此,这项工作提供了一种替代的 mRNA 吸入递送策略,显示出治疗 IPF 的巨大潜力。然后,移植 RGD 基序的核心暴露并特异性靶向整合素升高的细胞,以进行 mRNA 的细胞内递送。值得注意的是,反复吸入纳米制剂通过促进病灶内 MMP13 的表达和 KGFs 介导的肺泡上皮再形成,加速了局部胶原蛋白的清除,这协同改善了博莱霉素诱导的小鼠模型的肺功能。因此,这项工作提供了一种替代的 mRNA 吸入递送策略,显示出治疗 IPF 的巨大潜力。其协同改善博来霉素诱导的小鼠模型的肺功能。因此,这项工作提供了一种替代的 mRNA 吸入递送策略,显示出治疗 IPF 的巨大潜力。其协同改善博来霉素诱导的小鼠模型的肺功能。因此,这项工作提供了一种替代的 mRNA 吸入递送策略,显示出治疗 IPF 的巨大潜力。
更新日期:2022-02-11
中文翻译:

具有生物核糖体蛋白的吸入 mRNA 纳米制剂可逆转博来霉素诱导的小鼠模型中已建立的肺纤维化
特发性肺纤维化 (IPF) 是一种几乎没有治疗选择的致命呼吸系统疾病,由于肺泡上皮细胞 (AEC) 的反复微损伤而发生,并随着细胞外基质 (ECM) 的大量沉积而进展,最终导致纤维化疤痕并破坏肺泡建筑学。在这里,据报道,一种吸入的基于核糖体蛋白的 mRNA 纳米制剂可清除肺内 ECM 并使破坏的肺泡上皮重新上皮化,从而逆转 IPF 中已建立的纤维化病灶。该纳米制剂由核糖体蛋白浓缩的 mRNA 核心、双功能肽修饰的冠状病毒和具有聚乙二醇化屏蔽壳的角质形成细胞生长因子 (KGF) 依次组装而成。当通过雾化器吸入时,微滴携带的纳米制剂会沉积在肺泡中,并渗透到纤维化病灶中,在基质金属蛋白酶 2 (MMP2) 触发后,外部 KGF 分离。然后,移植 RGD 基序的核心暴露并特异性靶向整合素升高的细胞,以进行 mRNA 的细胞内递送。值得注意的是,反复吸入纳米制剂通过促进病灶内 MMP13 的表达和 KGFs 介导的肺泡上皮再形成,加速了局部胶原蛋白的清除,这协同改善了博莱霉素诱导的小鼠模型的肺功能。因此,这项工作提供了一种替代的 mRNA 吸入递送策略,显示出治疗 IPF 的巨大潜力。然后,移植 RGD 基序的核心暴露并特异性靶向整合素升高的细胞,以进行 mRNA 的细胞内递送。值得注意的是,反复吸入纳米制剂通过促进病灶内 MMP13 的表达和 KGFs 介导的肺泡上皮再形成,加速了局部胶原蛋白的清除,这协同改善了博莱霉素诱导的小鼠模型的肺功能。因此,这项工作提供了一种替代的 mRNA 吸入递送策略,显示出治疗 IPF 的巨大潜力。然后,移植 RGD 基序的核心暴露并特异性靶向整合素升高的细胞,以进行 mRNA 的细胞内递送。值得注意的是,反复吸入纳米制剂通过促进病灶内 MMP13 的表达和 KGFs 介导的肺泡上皮再形成,加速了局部胶原蛋白的清除,这协同改善了博莱霉素诱导的小鼠模型的肺功能。因此,这项工作提供了一种替代的 mRNA 吸入递送策略,显示出治疗 IPF 的巨大潜力。其协同改善博来霉素诱导的小鼠模型的肺功能。因此,这项工作提供了一种替代的 mRNA 吸入递送策略,显示出治疗 IPF 的巨大潜力。其协同改善博来霉素诱导的小鼠模型的肺功能。因此,这项工作提供了一种替代的 mRNA 吸入递送策略,显示出治疗 IPF 的巨大潜力。































 京公网安备 11010802027423号
京公网安备 11010802027423号