当前位置:
X-MOL 学术
›
J. Med. Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Discovery, X-ray Crystallography, and Anti-inflammatory Activity of Bromodomain-containing Protein 4 (BRD4) BD1 Inhibitors Targeting a Distinct New Binding Site
Journal of Medicinal Chemistry ( IF 6.8 ) Pub Date : 2022-01-04 , DOI: 10.1021/acs.jmedchem.1c01851 Zhiqing Liu , Yi Li , Haiying Chen , Hsien-Tsung Lai , Pingyuan Wang , Shwu-Yuan Wu , Eric A Wold , Paul G Leonard 1 , Sarah Joseph 1 , Haitao Hu , Cheng-Ming Chiang , Allan R Brasier 2 , Bing Tian , Jia Zhou
Journal of Medicinal Chemistry ( IF 6.8 ) Pub Date : 2022-01-04 , DOI: 10.1021/acs.jmedchem.1c01851 Zhiqing Liu , Yi Li , Haiying Chen , Hsien-Tsung Lai , Pingyuan Wang , Shwu-Yuan Wu , Eric A Wold , Paul G Leonard 1 , Sarah Joseph 1 , Haitao Hu , Cheng-Ming Chiang , Allan R Brasier 2 , Bing Tian , Jia Zhou
Affiliation
|
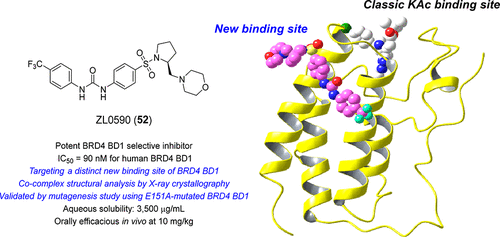
Bromodomain-containing protein 4 (BRD4) is an emerging epigenetic drug target for intractable inflammatory disorders. The lack of highly selective inhibitors among BRD4 family members has stalled the collective understanding of this critical system and the progress toward clinical development of effective therapeutics. Here we report the discovery of a potent BRD4 bromodomain 1 (BD1)-selective inhibitor ZL0590 (52) targeting a unique, previously unreported binding site, while exhibiting significant anti-inflammatory activities in vitro and in vivo. The X-ray crystal structural analysis of ZL0590 in complex with human BRD4 BD1 and the associated mutagenesis study illustrate a first-in-class nonacetylated lysine (KAc) binding site located at the helix αB and αC interface that contains important BRD4 residues (e.g., Glu151) not commonly shared among other family members and is spatially distinct from the classic KAc recognition pocket. This new finding facilitates further elucidation of the complex biology underpinning bromodomain specificity among BRD4 and its protein–protein interaction partners.
中文翻译:

针对独特新结合位点的含溴结构域蛋白 4 (BRD4) BD1 抑制剂的发现、X 射线晶体学和抗炎活性
含溴结构域蛋白 4 (BRD4) 是一种新兴的治疗顽固性炎症性疾病的表观遗传药物靶点。 BRD4 家族成员缺乏高度选择性的抑制剂,阻碍了对这一关键系统的集体理解以及有效疗法的临床开发进展。在此,我们报告发现了一种有效的 BRD4 溴结构域 1 (BD1) 选择性抑制剂 ZL0590 ( 52 ),该抑制剂针对独特的、以前未报道的结合位点,同时在体外和体内表现出显着的抗炎活性。 ZL0590 与人 BRD4 BD1 复合物的 X 射线晶体结构分析和相关诱变研究表明,位于螺旋 αB 和 αC 界面的一流非乙酰化赖氨酸 (KAc) 结合位点包含重要的 BRD4 残基(例如, Glu151)在其他家族成员中不常见,并且在空间上与经典的 KAc 识别口袋不同。这一新发现有助于进一步阐明 BRD4 及其蛋白质-蛋白质相互作用伙伴之间溴结构域特异性的复杂生物学基础。
更新日期:2022-02-10
中文翻译:

针对独特新结合位点的含溴结构域蛋白 4 (BRD4) BD1 抑制剂的发现、X 射线晶体学和抗炎活性
含溴结构域蛋白 4 (BRD4) 是一种新兴的治疗顽固性炎症性疾病的表观遗传药物靶点。 BRD4 家族成员缺乏高度选择性的抑制剂,阻碍了对这一关键系统的集体理解以及有效疗法的临床开发进展。在此,我们报告发现了一种有效的 BRD4 溴结构域 1 (BD1) 选择性抑制剂 ZL0590 ( 52 ),该抑制剂针对独特的、以前未报道的结合位点,同时在体外和体内表现出显着的抗炎活性。 ZL0590 与人 BRD4 BD1 复合物的 X 射线晶体结构分析和相关诱变研究表明,位于螺旋 αB 和 αC 界面的一流非乙酰化赖氨酸 (KAc) 结合位点包含重要的 BRD4 残基(例如, Glu151)在其他家族成员中不常见,并且在空间上与经典的 KAc 识别口袋不同。这一新发现有助于进一步阐明 BRD4 及其蛋白质-蛋白质相互作用伙伴之间溴结构域特异性的复杂生物学基础。































 京公网安备 11010802027423号
京公网安备 11010802027423号