当前位置:
X-MOL 学术
›
Ecotox. Environ. Saf.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
ATG14 和 SNARE 复合体相互作用减弱,阻碍自噬体-溶酶体融合,导致氟化物诱导的发育神经毒性
Ecotoxicology and Environmental Safety ( IF 6.2 ) Pub Date : 2021-12-22 , DOI: 10.1016/j.ecoenv.2021.113108 Yuanli Zhang 1 , Xie Han 1 , Yanling Tang 1 , Jingjing Zhang 1 , Zeyu Hu 1 , Wanjing Xu 1 , Ping Yao 1 , Qiang Niu 1

"点击查看英文标题和摘要"
更新日期:2021-12-23
Ecotoxicology and Environmental Safety ( IF 6.2 ) Pub Date : 2021-12-22 , DOI: 10.1016/j.ecoenv.2021.113108 Yuanli Zhang 1 , Xie Han 1 , Yanling Tang 1 , Jingjing Zhang 1 , Zeyu Hu 1 , Wanjing Xu 1 , Ping Yao 1 , Qiang Niu 1
Affiliation
|
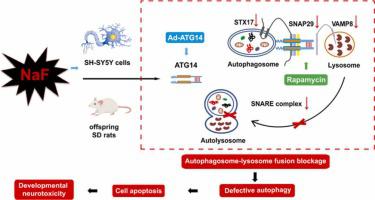
氟化物能够诱导发育神经毒性,但其机制仍不清楚。我们的目的是探讨自噬体-溶酶体融合在发育性氟化物神经毒性中的作用,特别关注 ATG14 和可溶性 N-乙基马来酰亚胺敏感因子附着蛋白受体 (SNARE) 复合物之间的相互作用。我们开发了从亲本大鼠怀孕到后代两个月大期间暴露于氟化钠 (NaF) 的 Sprague-Dawley 大鼠的体内模型,以及 NaF 和/或 Ad-ATG14 处理的 SH-SY5Y 细胞的体外模型。我们评估了后代的神经行为变化,并进一步研究了 NaF 暴露对自噬流、细胞凋亡、自噬体-溶酶体融合以及 ATG14 和 SNARE 复合体之间相互作用的影响。NaF 暴露会损害后代的学习和记忆能力,并诱导自噬体的积累、自噬流阻断和细胞凋亡,体内和体外 LC3-II、p62 和 cleaved-caspase-3 表达增加表明。此外,NaF处理下调ATG14和SNARE复合物的蛋白表达,并诱导自噬体-溶酶体融合阻断,这通过体内和体外ATG14、STX17、SNAP29和VAMP8表达的减少以及自噬体和溶酶体的共定位的减少来证明。此外,ATG14上调增强了ATG14与SNARE复合体的相互作用,促进自噬体-溶酶体融合,从而恢复自噬流并减轻NaF诱导的细胞凋亡。总之,NaF通过抑制ATG14与SNARE复合物的相互作用,阻碍自噬体-溶酶体融合而表现出发育神经毒性,从而参与氟化物神经毒性的发生和发展。值得注意的是,ATG14 上调可防止发育性氟化物神经毒性,并且 ATG14 可能作为进一步流行病学研究的有前景的生物标志物。

"点击查看英文标题和摘要"





















































 京公网安备 11010802027423号
京公网安备 11010802027423号