当前位置:
X-MOL 学术
›
J. Phys. Chem. B
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
水-离子相互作用如何控制水合电子的形成:钠阳离子接触对
The Journal of Physical Chemistry B ( IF 2.8 ) Pub Date : 2021-11-22 , DOI: 10.1021/acs.jpcb.1c08256
Sanghyun J Park 1 , Wilberth A Narvaez 1 , Benjamin J Schwartz 1
The Journal of Physical Chemistry B ( IF 2.8 ) Pub Date : 2021-11-22 , DOI: 10.1021/acs.jpcb.1c08256
Sanghyun J Park 1 , Wilberth A Narvaez 1 , Benjamin J Schwartz 1
Affiliation
|
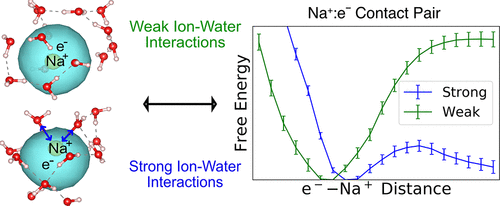
尽管溶剂化电子是一个长期受到关注的主题,但人们对它们在水性电解质中的行为方式却很少关注。实验上,已知水合电子的 ( e aq – ) 吸收光谱在存在盐的情况下会向蓝色移动,并且移动的幅度取决于离子浓度和阳离子和阴离子的同一性。蓝移是由体电解质的某种介电效应引起的,还是溶液中的水合电子和离子之间存在特定的相互作用?以前的工作表明,e aq –与 Na +等水性离子形成接触对,导致了什么控制了这种接触对的稳定性以及它们与观察到的光谱的可能联系的问题。在这项工作中,我们使用混合量子/经典模拟来检查水中 Na + : e -接触对的性质,使用一种新的量子伞式采样方法来构建平均力 (PMF) 的e aq -离子势。我们发现接触对 PMF 的性质敏感地取决于用于描述 Na + - 水相互作用的经典相互作用的选择。当离子-水相互作用稍强时,相应的阳离子:e -接触对在更长的距离处形成,并且在能量上变得更不稳定。我们证明这是因为在阳离子溶剂化、e aq溶剂化以及阳离子和电子之间的直接电子相互作用之间存在微妙的平衡,因此这种平衡的微小变化会导致形成和稳定性的巨大变化e –离子接触对。特别是,加强离子-水相互作用有助于在 Na +周围保持有利的局部溶剂化环境,这反过来又迫使阳离子的第一个溶剂化壳中的水分子不利地朝向接触对中的电子;阳离子的更强溶剂化也减少了电子重叠e aq –与 Na +。我们还发现,不同模型的 Na + : e –接触对的计算光谱不随阳离子-电子距离单调变化,并且计算的光谱变化比实验大一个数量级,这表明孤立的接触对是不是电解质存在下水合电子光谱蓝移的唯一解释。

"点击查看英文标题和摘要"
更新日期:2021-12-02

"点击查看英文标题和摘要"


































 京公网安备 11010802027423号
京公网安备 11010802027423号