当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Investigating the Hydrogen-Bonding Model of Urea Denaturation
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2009-07-08 , DOI: 10.1021/ja9016057 Laura B. Sagle 1 , Yanjie Zhang 1 , Vladislav A. Litosh 1 , Xin Chen 1 , Younhee Cho 1 , Paul S. Cremer 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2009-07-08 , DOI: 10.1021/ja9016057 Laura B. Sagle 1 , Yanjie Zhang 1 , Vladislav A. Litosh 1 , Xin Chen 1 , Younhee Cho 1 , Paul S. Cremer 1
Affiliation
|
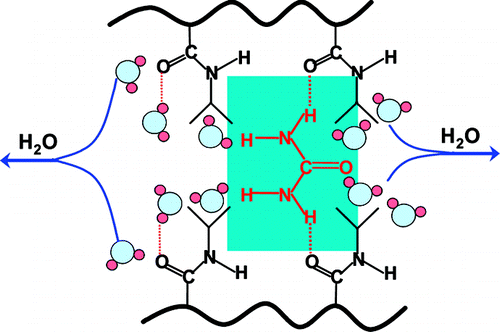
The direct binding mechanism for urea-based denaturation of proteins was tested with a thermoresponsive polymer, poly(N-isopropylacrylamide) (PNIPAM). Thermodynamic measurements of the polymer's hydrophobic collapse were complemented by Fourier transform infrared (FTIR) spectroscopy, Stokes radius measurements, and methylated urea experiments. It was found that the lower critical solution temperature (LCST) of PNIPAM decreased as urea was added to the solution. Therefore, urea actually facilitated the hydrophobic collapse of the macromolecule. Moreover, these thermodynamic measurements were strongly correlated with amide I band data which indicated that the decrease in the LCST was coupled to the direct hydrogen bonding of urea to the amide moieties of the polymer. In addition, the hydrogen bonding was found to be highly cooperative, which is consistent with a cross-linking (bivalent binding) mechanism. Cross-linking was confirmed by Stokes radius measurements below the polymer's LCST using gel filtration chromatography. Finally, phase transition measurements with methylurea, dimethylurea, and tetramethylurea indicated that these substituted compounds caused the LCST of PNIPAM to rise with increasing methyl group content. No evidence could be found for the direct binding of any of these methylated ureas to the polymer amide moieties by FTIR. These results are inconsistent with a direct hydrogen-bonding mechanism for the urea-induced denaturation of proteins.
中文翻译:

研究尿素变性的氢键模型
使用热响应聚合物聚(N-异丙基丙烯酰胺)(PNIPAM)测试了基于尿素的蛋白质变性的直接结合机制。聚合物疏水塌陷的热力学测量得到了傅里叶变换红外 (FTIR) 光谱、斯托克斯半径测量和甲基化尿素实验的补充。发现 PNIPAM 的下临界溶解温度 (LCST) 随着尿素添加到溶液中而降低。因此,尿素实际上促进了大分子的疏水塌陷。此外,这些热力学测量与酰胺 I 带数据密切相关,这表明 LCST 的降低与尿素与聚合物酰胺部分的直接氢键结合有关。此外,发现氢键是高度合作的,这与交联(二价结合)机制一致。使用凝胶过滤色谱法通过低于聚合物 LCST 的斯托克斯半径测量证实了交联。最后,甲基脲、二甲基脲和四甲基脲的相变测量表明,这些取代的化合物导致 PNIPAM 的 LCST 随着甲基含量的增加而升高。通过 FTIR 没有发现任何这些甲基化脲与聚合物酰胺部分直接结合的证据。这些结果与尿素诱导蛋白质变性的直接氢键机制不一致。甲基脲、二甲基脲和四甲基脲的相变测量表明,这些取代的化合物导致 PNIPAM 的 LCST 随着甲基含量的增加而升高。通过 FTIR 没有发现任何这些甲基化脲与聚合物酰胺部分直接结合的证据。这些结果与尿素诱导蛋白质变性的直接氢键机制不一致。甲基脲、二甲基脲和四甲基脲的相变测量表明,这些取代的化合物导致 PNIPAM 的 LCST 随着甲基含量的增加而升高。通过 FTIR 没有发现任何这些甲基化脲与聚合物酰胺部分直接结合的证据。这些结果与尿素诱导蛋白质变性的直接氢键机制不一致。
更新日期:2009-07-08
中文翻译:

研究尿素变性的氢键模型
使用热响应聚合物聚(N-异丙基丙烯酰胺)(PNIPAM)测试了基于尿素的蛋白质变性的直接结合机制。聚合物疏水塌陷的热力学测量得到了傅里叶变换红外 (FTIR) 光谱、斯托克斯半径测量和甲基化尿素实验的补充。发现 PNIPAM 的下临界溶解温度 (LCST) 随着尿素添加到溶液中而降低。因此,尿素实际上促进了大分子的疏水塌陷。此外,这些热力学测量与酰胺 I 带数据密切相关,这表明 LCST 的降低与尿素与聚合物酰胺部分的直接氢键结合有关。此外,发现氢键是高度合作的,这与交联(二价结合)机制一致。使用凝胶过滤色谱法通过低于聚合物 LCST 的斯托克斯半径测量证实了交联。最后,甲基脲、二甲基脲和四甲基脲的相变测量表明,这些取代的化合物导致 PNIPAM 的 LCST 随着甲基含量的增加而升高。通过 FTIR 没有发现任何这些甲基化脲与聚合物酰胺部分直接结合的证据。这些结果与尿素诱导蛋白质变性的直接氢键机制不一致。甲基脲、二甲基脲和四甲基脲的相变测量表明,这些取代的化合物导致 PNIPAM 的 LCST 随着甲基含量的增加而升高。通过 FTIR 没有发现任何这些甲基化脲与聚合物酰胺部分直接结合的证据。这些结果与尿素诱导蛋白质变性的直接氢键机制不一致。甲基脲、二甲基脲和四甲基脲的相变测量表明,这些取代的化合物导致 PNIPAM 的 LCST 随着甲基含量的增加而升高。通过 FTIR 没有发现任何这些甲基化脲与聚合物酰胺部分直接结合的证据。这些结果与尿素诱导蛋白质变性的直接氢键机制不一致。






























 京公网安备 11010802027423号
京公网安备 11010802027423号