当前位置:
X-MOL 学术
›
Anal. Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Real-Time Investigation of Intracellular Polynucleotide Kinase Using a Cascaded Amplification Circuit
Analytical Chemistry ( IF 6.7 ) Pub Date : 2021-11-08 , DOI: 10.1021/acs.analchem.1c04033 Jinhua Shang 1 , Shanshan Yu 1 , Yingying Chen 1 , Yuhui Gao 1 , Chen Hong 1 , Fengzhe Li 1 , Fuan Wang 1
Analytical Chemistry ( IF 6.7 ) Pub Date : 2021-11-08 , DOI: 10.1021/acs.analchem.1c04033 Jinhua Shang 1 , Shanshan Yu 1 , Yingying Chen 1 , Yuhui Gao 1 , Chen Hong 1 , Fengzhe Li 1 , Fuan Wang 1
Affiliation
|
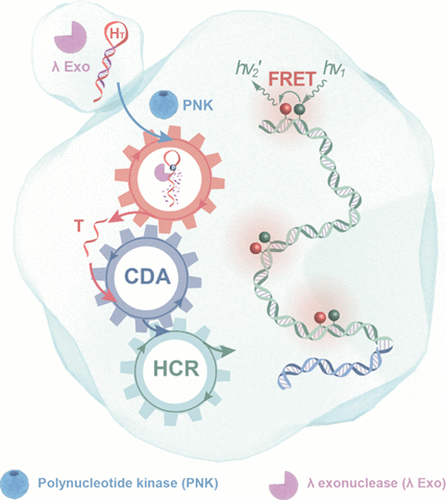
Polynucleotide kinase (PNK) shows an in-depth correlationship with DNA repair and metabolism processes. The in situ visualization of intracellular PNK revealed an extremely biological significance in supplementing reliable and quantitative information on its spatiotemporal distribution in live cells. Herein, we developed a versatile cascaded DNA amplification circuit through the integration of catalytic DNA assembly and hybridization chain reaction circuits and realized the accurate evaluation of intracellular PNK activity via the Förster resonance energy transfer (FRET) principle. Initially, without PNK, trigger T was firmly caged in the PNK-recognizing hairpin HT, resulting in no disturbance of the concatenated circuit. However, with the introduction of PNK, the 5′-OH terminal of PNK-addressing HT was phosphorylated, then the phosphorylated HT could be subsequently digested by λ exonuclease (λ Exo) to produce trigger T of the cascaded DNA circuit. As a result, the integrated circuit was stimulated to produce an amplified FRET signal for quantitatively monitoring the activity of PNK. Due to the λ Exo-specific digestion of 5′-phosphate DNA and the high signal gain of the cascade circuit, our proposed strategy enables the sensitive analysis of PNK activity in vitro and in complex biological samples. Furthermore, our PNK-sensing platform was extensively explored in HeLa cells for realizing reliable intracellular PNK imaging and thus showed high potential in the future diagnosis and treatment of kinase-related diseases.
中文翻译:

使用级联放大电路实时研究细胞内多核苷酸激酶
多核苷酸激酶 (PNK) 显示出与 DNA 修复和代谢过程的深入相关性。细胞内 PNK 的原位可视化揭示了在补充有关其在活细胞中的时空分布的可靠和定量信息方面具有极其重要的生物学意义。在此,我们通过催化 DNA 组装和杂交链反应电路的集成开发了一种多功能级联 DNA 放大电路,并通过 Förster 共振能量转移(FRET)原理实现了对细胞内 PNK 活性的准确评估。最初,在没有 PNK 的情况下,触发器T被牢牢固定在 PNK 识别发夹H T 中,从而不会对串联电路造成干扰。然而,随着 PNK 的引入,PNK 寻址的H T的 5'-OH 末端被磷酸化,然后磷酸化的H T可以随后被 λ 核酸外切酶(λ Exo)消化以产生触发T级联 DNA 电路。结果,集成电路受到刺激以产生放大的 FRET 信号,用于定量监测 PNK 的活性。由于 5'-磷酸 DNA 的 λ Exo 特异性消化和级联电路的高信号增益,我们提出的策略能够在体外和复杂生物样品中对 PNK 活性进行灵敏分析。此外,我们的 PNK 传感平台在 HeLa 细胞中进行了广泛的探索,以实现可靠的细胞内 PNK 成像,因此在未来激酶相关疾病的诊断和治疗中显示出巨大的潜力。
更新日期:2021-11-23
中文翻译:

使用级联放大电路实时研究细胞内多核苷酸激酶
多核苷酸激酶 (PNK) 显示出与 DNA 修复和代谢过程的深入相关性。细胞内 PNK 的原位可视化揭示了在补充有关其在活细胞中的时空分布的可靠和定量信息方面具有极其重要的生物学意义。在此,我们通过催化 DNA 组装和杂交链反应电路的集成开发了一种多功能级联 DNA 放大电路,并通过 Förster 共振能量转移(FRET)原理实现了对细胞内 PNK 活性的准确评估。最初,在没有 PNK 的情况下,触发器T被牢牢固定在 PNK 识别发夹H T 中,从而不会对串联电路造成干扰。然而,随着 PNK 的引入,PNK 寻址的H T的 5'-OH 末端被磷酸化,然后磷酸化的H T可以随后被 λ 核酸外切酶(λ Exo)消化以产生触发T级联 DNA 电路。结果,集成电路受到刺激以产生放大的 FRET 信号,用于定量监测 PNK 的活性。由于 5'-磷酸 DNA 的 λ Exo 特异性消化和级联电路的高信号增益,我们提出的策略能够在体外和复杂生物样品中对 PNK 活性进行灵敏分析。此外,我们的 PNK 传感平台在 HeLa 细胞中进行了广泛的探索,以实现可靠的细胞内 PNK 成像,因此在未来激酶相关疾病的诊断和治疗中显示出巨大的潜力。































 京公网安备 11010802027423号
京公网安备 11010802027423号