当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
来自人类和疟疾寄生虫恶性疟原虫的乳酸脱氢酶的结构、功能和热力学
Biochemistry ( IF 2.9 ) Pub Date : 2021-11-08 , DOI: 10.1021/acs.biochem.1c00470
Sergei Khrapunov 1 , Akiba Waterman 2 , Rudra Persaud 2 , Eric P Chang 2
Biochemistry ( IF 2.9 ) Pub Date : 2021-11-08 , DOI: 10.1021/acs.biochem.1c00470
Sergei Khrapunov 1 , Akiba Waterman 2 , Rudra Persaud 2 , Eric P Chang 2
Affiliation
|
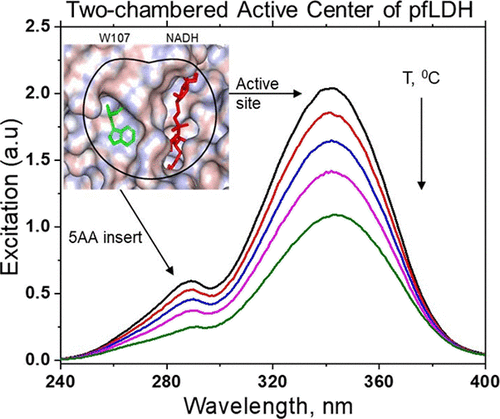
温度适应在所有生物体中无处不在,但这一过程的分子基础仍然知之甚少。可以假设,对于寄生虫-宿主系统,在两种生物体中发现的相同酶对相同的选择因子(人体温度)作出反应,并具有相似的结构变化。在此,我们报告了来自疟疾寄生虫恶性疟原虫的糖酵解酶乳酸脱氢酶 (LDH) 存在可逆的温度依赖性结构转变(pfLDH) 和人类心脏 (hhLDH) 发生在人类发热的温度范围内。在其工作温度范围内,从嗜冷菌、嗜温菌和中等嗜热菌的 LDH 中观察到了这种转变。热力学分析揭示了 LDH-底物复合物的独特热力学特征,定义了人类 LDH 适应的特定温度范围,而寄生虫 LDH 则不适应,尽管它们具有共同的嗜温性质。光谱分析的结果与可用的晶体学数据相结合,揭示了 pfLDH 中存在一个活性中心,该中心赋予酶嗜冷结构特性。该中心由两个口袋组成,一个由底物特异性环内的五个氨基酸(5AA 插入)形成,另一个由活性位点形成,它们相互调节以响应温度并引起 Michaelis 复合体的结构和功能变化。我们的发现为疟疾治疗和药物设计的新策略铺平了道路,该策略使用治疗剂在周期性疟疾发作的特定温度范围内选择性地灭活疟疾 LDH。

"点击查看英文标题和摘要"
更新日期:2021-11-30

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号