当前位置:
X-MOL 学术
›
BBA Proteins Proteom.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
人类 71 kDa 热休克同源蛋白 (HSPA8/hHsc70) 的结构、热力学和功能研究
Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics ( IF 2.5 ) Pub Date : 2021-09-25 , DOI: 10.1016/j.bbapap.2021.140719
Noeli Soares Melo Silva 1 , Luiz Fernando de Camargo Rodrigues 2 , Paulo Roberto Dores-Silva 3 , Carlos Alberto Montanari 1 , Carlos Henrique Inácio Ramos 4 , Leandro Ramos Souza Barbosa 5 , Júlio César Borges 1

"点击查看英文标题和摘要"
更新日期:2021-09-30
Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics ( IF 2.5 ) Pub Date : 2021-09-25 , DOI: 10.1016/j.bbapap.2021.140719
Noeli Soares Melo Silva 1 , Luiz Fernando de Camargo Rodrigues 2 , Paulo Roberto Dores-Silva 3 , Carlos Alberto Montanari 1 , Carlos Henrique Inácio Ramos 4 , Leandro Ramos Souza Barbosa 5 , Júlio César Borges 1
Affiliation
|
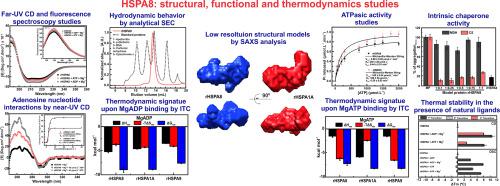
人类 71 kDa 热休克同源蛋白(HSPA8,也称为 Hsc70、Hsp70-8、Hsc71、Hsp71 或 Hsp73)是组成型表达的分子伴侣,对细胞蛋白质稳态至关重要。在胞质溶胶中,HSPA8 在折叠和重折叠中起关键作用,促进蛋白质跨膜运输并靶向蛋白质降解等功能。在这里,我们报告了使用各种生物物理和生物化学方法对重组 HSPA8 (rHSPA8) 进行的溶液研究。rHSPA8 与其他人类 Hsp70 共享几个结构和功能相似之处。它有两个稳定性不同的结构域,并与具有低微摩尔范围解离常数的腺苷核苷酸相互作用,在存在 Mg 2+ 时更高. rHSPA8 的 ATPase 活性低于其同源物 HSPA5/hGrp78/hBiP,但比重组 HSPA1A/hHsp70-1A 高 4 倍,与重组 HSPA1A/hHsp70-1A 的同一性为 86%。小角度 X 射线散射表明 rHSPA8 在溶液中表现为细长的单体蛋白质,其尺寸与观察到的 HSPA1A 相似。此外,rHSPA8 在其压缩和扩展构象之间显示出结构灵活性。数据还表明 HSPA8 具有阻止模型客户蛋白质聚集的能力。本研究扩展了对该分子伴侣的结构和活性的理解,并与人类同源 Hsp70 具有不同功能的观点一致。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号