Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
整合素α2的位点特异性N-糖基化介导胶原依赖性细胞存活
iScience ( IF 4.6 ) Pub Date : 2021-09-25 , DOI: 10.1016/j.isci.2021.103168 Yen-Lin Huang 1 , Ching-Yeu Liang 1 , Vera Labitzky 2 , Danilo Ritz 3 , Tiago Oliveira 4 , Cécile Cumin 1 , Manuela Estermann 5 , Tobias Lange 2 , Arun V Everest-Dass 4 , Francis Jacob 1

"点击查看英文标题和摘要"
更新日期:2021-10-06
iScience ( IF 4.6 ) Pub Date : 2021-09-25 , DOI: 10.1016/j.isci.2021.103168 Yen-Lin Huang 1 , Ching-Yeu Liang 1 , Vera Labitzky 2 , Danilo Ritz 3 , Tiago Oliveira 4 , Cécile Cumin 1 , Manuela Estermann 5 , Tobias Lange 2 , Arun V Everest-Dass 4 , Francis Jacob 1
Affiliation
|
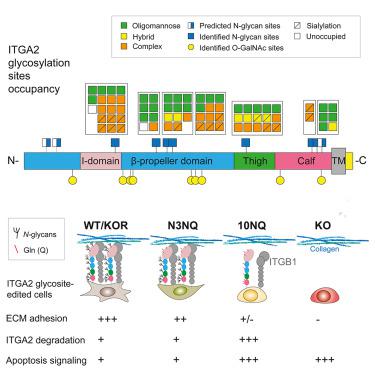
Integrin alpha 2 (ITGA2) 通过选择性粘附到 ECM 蛋白来促进癌症转移;然而,整合素糖基化的具体贡献仍不确定。我们提供证据表明 ITGA2 是一种高度糖基化的跨膜蛋白,在卵巢癌组织和细胞系中表达。深入的糖蛋白质组学鉴定了主要的N - 和O -糖基化位点,这些位点具有显着不同的 ITGA2 糖基化特征。生成的推定 ITGA2 N-糖苷位突变体停止了胶原蛋白和层粘连蛋白的结合以及缺乏N 的细胞-糖基化的 ITGA2 略微粘附于胶原蛋白,可能与其通过多泛素化增强的蛋白酶体降解有关。蛋白质组学和富集途径分析显示非糖基化 ITGA2 突变细胞中细胞凋亡和胶原组织增加。此外,我们提供了 ITGA2 特异性唾液酸化参与选择性细胞 ECM 结合的证据。这些结果强调了聚糖在调节 ITGA2 稳定性和配体结合能力方面的重要性,这反过来调节下游粘着斑并促进细胞在胶原蛋白环境中的存活。

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号